人工晶体涂层
Front Bioeng Biotech 2022: 人工晶体载药涂层

背景
后囊膜混浊(PCO)是白内障术后最常见的迟发性并发症之一。设计了多种药物洗脱人工晶状体(IOL),以实现药物的持续释放,抑制白内障术后眼部炎症、晶状体上皮细胞(LECs)的增殖和后发性白内障的发生。尽管在该领域已有进展,但载药IOL存在眼毒性、载药能力不足、释放时间短等问题。为了防止PCO的发生并解决这些问题,本研究采用两步自旋涂层法,由二维超薄Ti3C2 MXene纳米片和雷帕霉素(Rapa)制备了一种新型载药IOL (Rapa@Ti3C2-IOL)。Ti3C2作为Rapa的给药库。Rapa@Ti3C2-IOL具有光热和近红外(NIR)可控的协同释药特性。结果表明,Rapa@Ti3C2-IOL具有制备简单、透光率高、光热转化能力优异、NIR可控的释药行为等优点。在温和的808 nm近红外激光(1.0 W/cm−2)照射下,Rapa@Ti3C2涂层有效地消除了Rapa@Ti3C2-IOL周围的LECs。此外,NIR可控的Rapa释放抑制了LEC的迁移,抑制了体外光热治疗后的炎症反应。然后将Rapa@Ti3C2-IOL植入鼠兔眼内,观察4周后预防PCO的有效性和生物相容性。在近红外照射下,Rapa@ Ti3C2-IOL植入物具有良好的PCO预防能力,对周围健康组织无明显病理损伤。本研究提供了一种具有协同光热和NIR可控的超薄Ti3C2 MXene纳米片IOL来预防PCO的有希望的策略Rapa释放属性。
图文导读
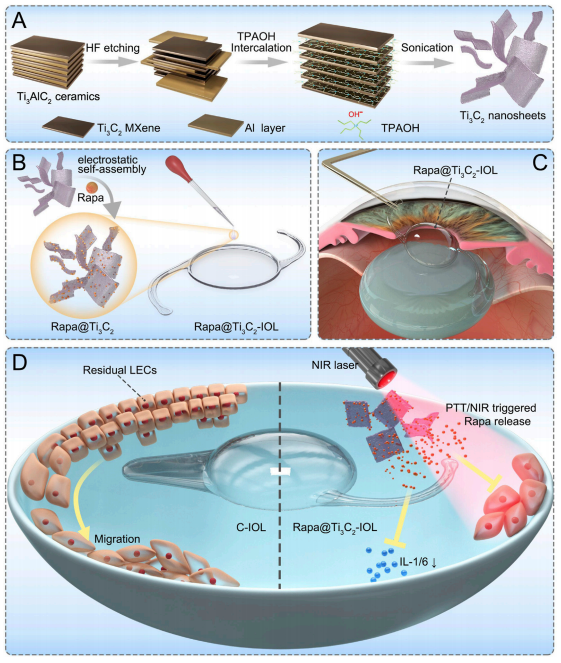
(图1 Rapa@Ti3C2-IOL协同光热和NIR可控Rapa释放疗法预防PCO的方案)
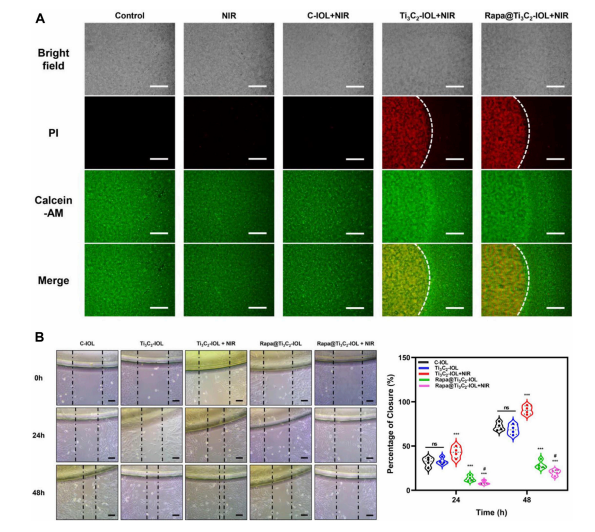
(图2 Rapa@Ti3C2-IOL的体外光热烧蚀和抗迁移作用)
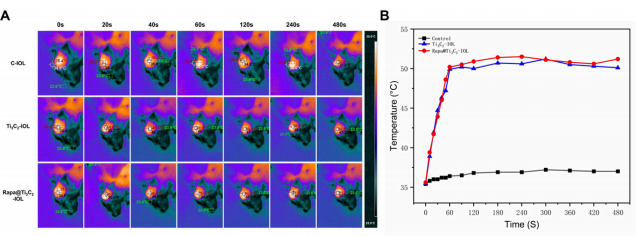
(图3 Rapa@Ti3C2-IOL的体内光热性能)
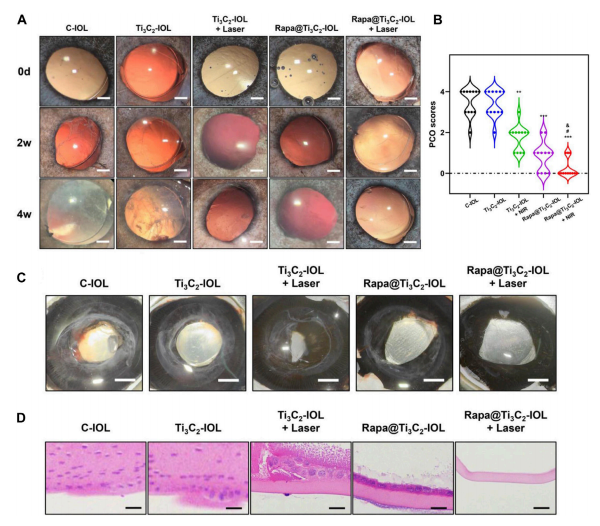
(图4 Rapa@Ti3C2-IOL植入体内预防PCO)
全文总结
在这里,将Rapa@Ti3C2涂在IOL的光学部分表面,即Rapa@Ti3C2-IOL上,用于联合PTT和NIR可控药物释放疗法预防PCO。该Rapa@Ti3C2-IOL体系具有与商业疏水IOL较高的透光率、中等折射率和相当的应变应力和拉伸特性。由于Ti3C2的高光热转换效率,Rapa在808 nm NIR照射下实现了Rapa的可控释放行为。NIR触发的Rapa释放有利于抑制光热治疗后LECs的迁移,抑制炎症反应。Rapa@Ti3C2-IOL的协同治疗研究表明,在体内外均具有良好的LECs杀伤能力和PCO预防能力。此外,Rapa@Ti3C2- IOL对其他眼内组织的毒性可以忽略不计,这使得它有望在临床转化中得到应用。这种具有优异的治疗效率和高生物相容性的Rapa@Ti3C2-IOL纳米系统可能作为一种很有前途的预防PCO的策略。
原文链接: https://doi.org/10.3389/fbioe.2022.989099
仅用于学术分享,侵权请联系删除,欢迎交流。
| 温馨提示:苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。网站部分文献案例图片源自互联网,图片仅供参考,请以实物为主,如有侵权请联系我们立即删除。 |
上一篇: 人骨肉瘤


