纳米药物递送系统:用于肿瘤化学免疫联合治疗的研究进展
化疗免疫联合治疗具有协同治疗机制、减少用药剂量和增强治疗效果等优势,是一种很有潜力的肿瘤治疗方法。然而,两种治疗剂的药代动力学性质和体内分布不同、作用靶点不一致、肿瘤部位的药物比例不可控以及严重的全身副作用等影响协同抗肿瘤效果。纳米药物递送系统因其具有改善药物药动学性质、肿瘤靶向递送能力、肿瘤微环境响应性定点释药等特性,用于化疗免疫治疗剂的递送,有助于获得更优的协同抗肿瘤效果,具有潜在临床应用前景。
A Review on Nano-Based Drug Delivery System for Cancer ChemoimmunotherapyWeiwei Mu, Qihui Chu, Yongjun Liu, Na Zhang*
Nano‑Micro Lett.(2020)12:142
https://doi.org/10.1007/s40820-020-00482-6
本文亮点
1. 本文总结了目前肿瘤免疫治疗的方法。
2. 探讨了肿瘤化学免疫联合治疗的研究现状及应用前景。
3. 讨论和阐述了纳米药物递送系统用于肿瘤化学免疫治疗的最新研究进展。k
内容简介
山东大学药学院药剂学研究所张娜教授团队回顾并系统总结了纳米药物递送系统应用于肿瘤化学免疫联合治疗的最新研究进展。
免疫治疗是一种通过调节免疫系统而不是专注于肿瘤细胞本身发挥作用的新型治疗手段,是肿瘤治疗的最新有效方法。然而,免疫检查点抑制剂的耐药性、治疗性疫苗的免疫原性弱、脱靶效应、严重的免疫相关不良事件(iRAE)等使某些肿瘤类型或患者的免疫治疗遭遇挑战。
大量的临床前研究证明,化疗可能为免疫治疗提供额外帮助,一些细胞毒性药物可以激发抗肿瘤免疫,如CDK4/6抑制剂能够刺激IFN-III的产生并增强肿瘤抗原提呈。合理的化学免疫联合治疗能够协同提高抗肿瘤效果。
为了确保最佳的化学免疫协同抗肿瘤效果,联用过程中需要注意两种药物的药代动力学性质差异和体内分布不同,肿瘤靶向特异性和肿瘤蓄积不足,肿瘤组织中药物比例不确定,以及严重的全身副作用等问题。纳米药物递送系统(NDDS)可以改善药物在体内的药代动力学行为,增加药物稳定性,实现靶向给药和药物控释,在化学免疫联合治疗领域有着广阔的应用前景。将NDDS应用于化学免疫联合治疗是目前肿瘤治疗的研究热点。本文综述了NDDS应用于肿瘤化学免疫联合治疗的最新研究进展。
图文导读
I 肿瘤免疫治疗
肿瘤免疫包括肿瘤细胞抗原释放、抗原提呈细胞提呈抗原、T细胞启动和激活、T细胞向肿瘤组织迁移和浸润,及细胞毒性T细胞对肿瘤细胞的识别和杀伤等几个关键步骤。每一步骤都有可能成为潜在的治疗靶点。针对这些靶点,目前的肿瘤免疫治疗方法主要包括治疗性抗体、肿瘤疫苗、过继细胞治疗和细胞因子治疗。
II 肿瘤化学免疫联合治疗
肿瘤化学免疫联合治疗是一种很有潜力的提高抗肿瘤疗效的方法。化疗药物可能通过增强肿瘤细胞免疫原性,影响调节T细胞(Treg)、髓源性抑制细胞(MDSCs)和树突状细胞(DCs)等免疫细胞的功能来调节肿瘤免疫。研究表明,适当剂量的化疗药物可以通过上调肿瘤抗原和MHC-I的表达,诱导共刺激分子的表达,下调肿瘤细胞表面的免疫检查点分子表达等途径来增强肿瘤细胞的内源性免疫原性。适当剂量的化疗药物可以调节Treg的抑制作用。例如,玻玛西尼与PD-L1抑制剂联合治疗MMTV-RTTA/Teto-HER2肿瘤小鼠的研究结果表明,两药联用与单药治疗分别比较治疗效果增强,肿瘤体积在第13天缩小~70%。
肿瘤化学免疫联合治疗临床试验也显示出可喜结果。研究表明,CD40抗体联合顺铂/培美曲塞治疗恶性胸膜间皮瘤,有更多的患者出现一过性肿瘤特异性T细胞免疫应答,有三位患者实现长期生存(超过30个月)。卡铂或顺铂与培美曲塞联合派姆单抗的组合已被FDA批准作为转移性、非鳞状非小细胞肺癌患者的一线治疗方案。
然而,也有一些化学免疫联合治疗肿瘤的临床试验效果不理想,患者之间疗效差异大,许多患者免疫反应不佳。因此,需要探索进一步提高化学免疫联合治疗免疫应答效果的新策略。
III 纳米药物递送系统用于肿瘤化学免疫联合治疗
NDDS为提高肿瘤的化学免疫联合治疗效果提供了新途径。目前有几种灵活的方法利用NDDS实现化学免疫联合治疗。如,一种药物可以以游离形式给药,另外一种药物可以通过NDDS给药(Free drug+Nano),或者两种药物分别由相似或不同的NDDS递送(Nano+Nano),或者两种药物共包载于同一个纳米载体中(co-encapsulation)。
Free drug+Nano 策略具有处方灵活可调、给药间隔可控、制备简单、易于工业化放大和临床转化等优点。 Nano+Nano 策略具有配方灵活,给药剂量可调,两种制剂分布相似等优势。我们研究团队针对不同的靶细胞制备了双胞胎样纳米粒(TCN),分别靶向递送索拉非尼到肿瘤细胞和IMD-0354到巨噬细胞,以增强肿瘤化疗和免疫治疗效果。这两种TCN的体内分布相似,可以实现靶向递送不同药物到不同细胞,从而确保协同抗肿瘤效果。
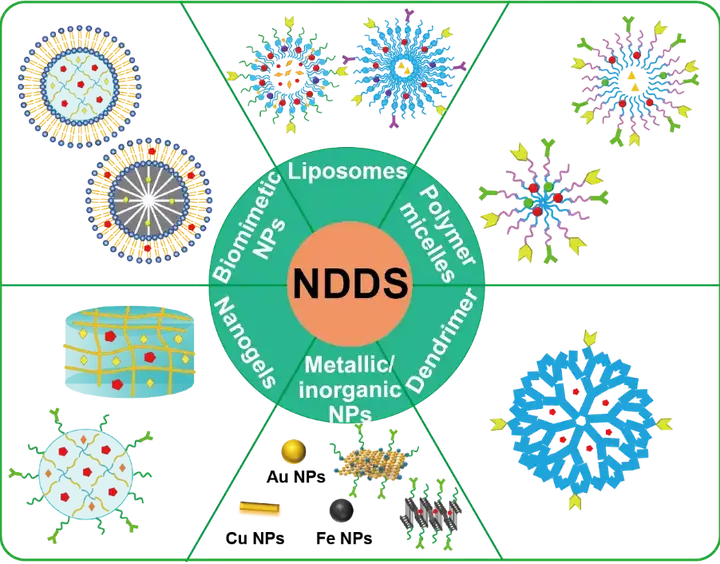
co-encapsulation 策略可以控制药物在肿瘤组织中的积聚,保证药物的可控释放,控制多种药物的时空递送。目前,已有各种各样的NDDS应用于化学免疫联合治疗,包括脂质体、聚合物胶束、树枝状大分子、金属和无机纳米粒、纳米凝胶和仿生纳米粒等(图1)。
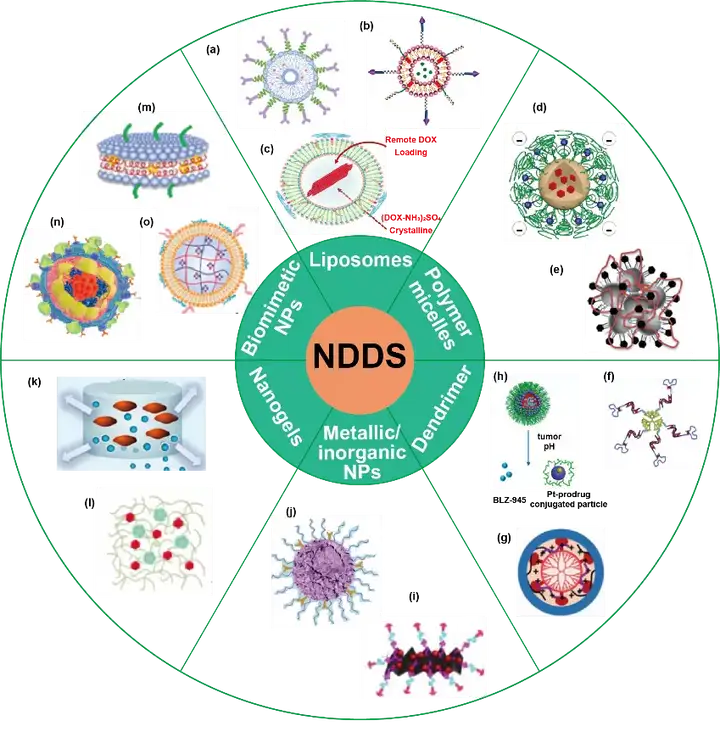
图1. NDDS co-encapsulation 策略应用于肿瘤化学免疫联合治疗。3.1 脂质体
脂质体具有包封率高、靶向性好、毒性低等优点,作为化学免疫联合治疗的载体被广泛研究。亲水性治疗剂可以被包裹在脂质体内,疏水性治疗剂可以被包载于脂质双分子层中,治疗剂也可以通过与脂质之间的电荷相互作用或与脂质分子的化学链接,装载于脂质体内或脂质体表面。如图2,Lu等制备了一种共载多柔比星和IDO-1抑制剂(IND)的脂质体(DOX/IND-liposome)。DOX/IND-liposome通过磷脂与IND偶联自组装,通过主动载药方式装载多柔比星。结果表明,DOX/IND-liposome显著增强抗乳腺癌免疫应答。
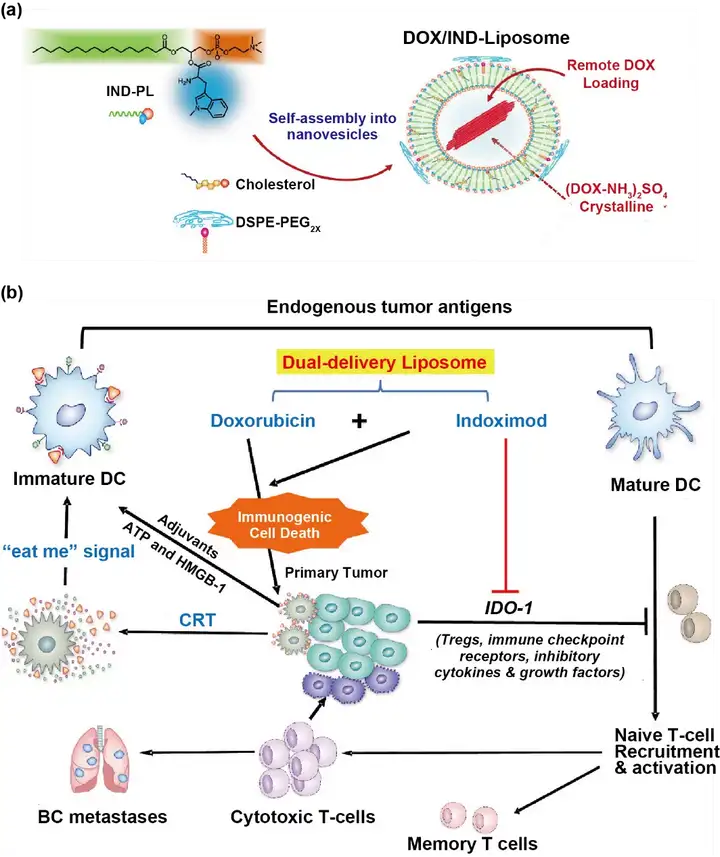
图2.脂质体用于肿瘤化学免疫联合治疗。
3.2 聚合物胶束
聚合物胶束具有疏水内核和亲水外壳,具有制备简单、可同时装载多种药物和易于表面修饰的特点。疏水性药物可以被包载于胶束的疏水内核中,亲水性药物可以通过化学偶联来负载。聚合物胶束应用于肿瘤化学免疫联合治疗时,由于其粒径较小,易于随淋巴管渗透至淋巴结内,有利于肿瘤抗原和免疫佐剂的递送。Juan C. Mareque-Rivas等报道了一种Pt(IV)前药物修饰的聚乙二醇化磷脂胶束,胶束包裹氧化铁纳米粒(IONP)后用Poly(I:C)修饰,用于肿瘤化学免疫联合治疗。该胶束明显增强了对肿瘤细胞的杀伤作用(图3)。
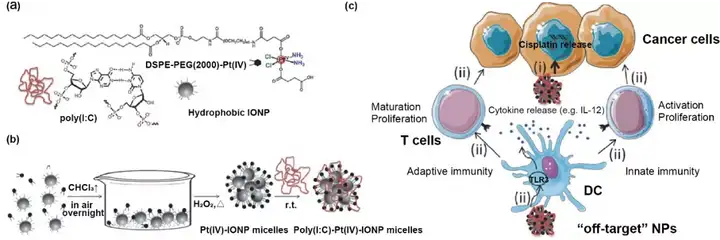
图3. 聚合物胶束用于肿瘤化学免疫联合治疗。
3.3 树枝状聚合物
树枝状聚合物如PAMAM,PEI等,具有化学结构明确、单分散、易实现多功能和多价修饰等特点被广泛研究。树枝状大分子的疏水内核可以负载小分子药物,而功能化外周基团可通过化学连接免疫治疗剂,如治疗性抗体等。如图4,He等设计了一种基于PAMAM共载多柔比星和CpG的纳米粒(LMWH/PPD/CpG),用于转移性黑色素瘤的化疗免疫联合治疗。多柔比星通过pH敏感的腙键连接在PAMAM的末端氨基上。带负电荷的低分子肝素包覆于PAMAM表面形成LMWH/PPD/CpG。LMWH/PPD/CpG明显增强荷黑色素瘤小鼠免疫应答和治疗效果。
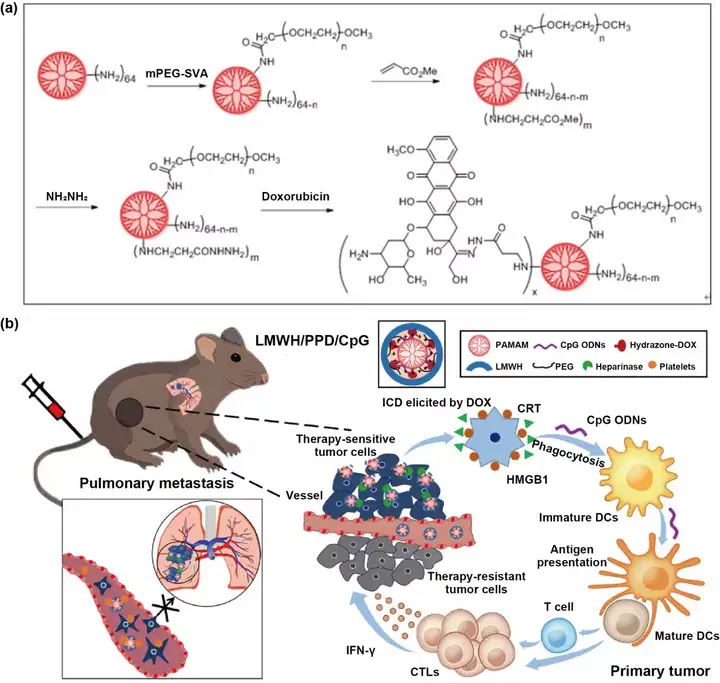
图4. 树枝状大分子用于肿瘤化学免疫联合治疗。
3.4 金属/无机纳米粒
金属和无机纳米粒通常具有光热治疗(PTT)和光动力治疗(PDT)效果,载药量高、易于功能化修饰、无免疫原性,既是良好的药物载体又是肿瘤治疗剂。目前许多金属和无机纳米粒已被用于化学免疫联合治疗研究,包括氧化石墨烯类纳米粒、介孔二氧化硅纳米粒、黑磷纳米粒、金纳米粒和铜纳米粒等。Dong等设计多功能CuS纳米粒(FA-CD@PP-CpG)用于CpG和多西他赛共递送,并协同PDT和PTT,获得增强的乳腺癌治疗效果。FA-CD@PP-CpG可以促进CTL浸润,抑制MDSCs,提高4T1-荷瘤小鼠的抗肿瘤效果(图5)。
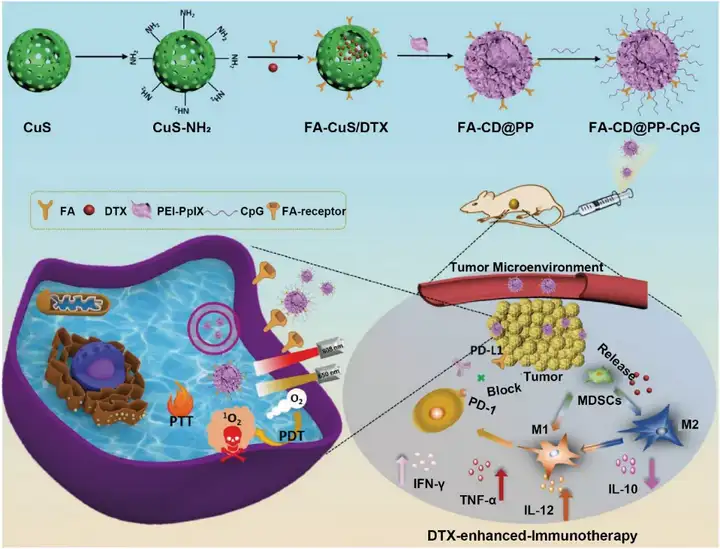
图5. 金属纳米粒用于肿瘤化学免疫联合治疗。
3.5 纳米凝胶
纳米凝胶是具有纳米尺度的水凝胶支架,具有良好的生物相容性、高含水量以及与各种治疗剂(如小分子药物和生物大分子药物)良好的兼容性,被广泛应用于化学免疫联合治疗研究。通过靶向配体修饰、响应性功能键合成等手段,可以合理设计多功能纳米凝胶用于提升化学免疫联合治疗效果。Yang等报道了一种蜂毒素-RADA32水凝胶装载多柔比星,通过主动调节肿瘤微环境增强化学免疫联合治疗效果。该水凝胶通过控制药物释放、调节固有免疫细胞(如促进DC成熟)和耗竭M2型巨噬细胞增强对黑色素瘤的杀伤作用(图6)。
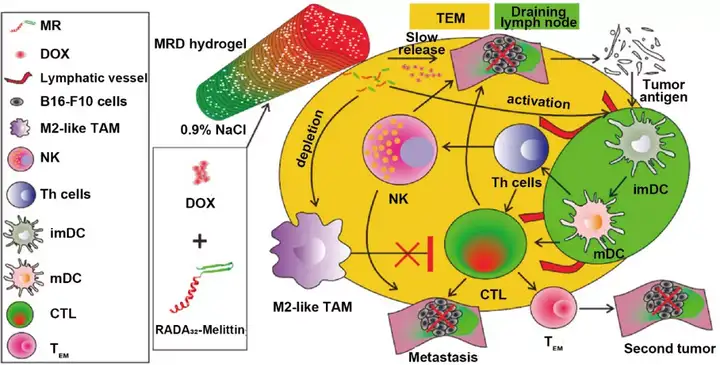
图6. 纳米凝胶用于肿瘤化学免疫联合治疗。
3.6 仿生纳米载体
仿生纳米载体具有仿天然的结构或形态、表面性质和大小,具有更强的靶向性和良好的生物相容性,可将药物输送到靶细胞或组织。白蛋白、高密度脂蛋白、低密度脂蛋白、转铁蛋白家族蛋白及其衍生蛋白等制备的仿生纳米粒已被应用于肿瘤化学免疫联合治疗研究。细胞膜仿生纳米粒主要由细胞膜包裹功能纳米粒组成。细胞膜仿生纳米粒上的细胞膜蛋白保持其生物活性,从而使细胞膜仿生纳米粒具有免疫逃逸、延长血液循环时间和肿瘤靶向的能力。不同的细胞膜使仿生纳米粒在肿瘤治疗中具有不同的功能。红细胞膜仿生纳米粒可以提高生物相容性和生物降解性,延长血液循环时间。Zhang等开发了一种红细胞膜包覆纳米粒(NRP+I),用于多西他赛和IL-2的共递送(图7)。该仿生纳米粒NRP+I具有增强的抗肿瘤免疫效果和药物肿瘤组织深层渗透性能。
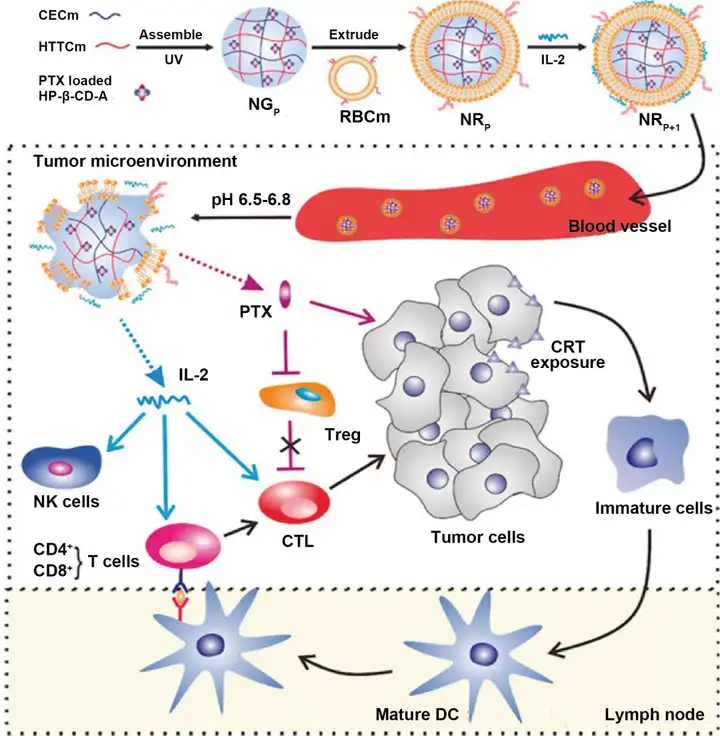
图7. 仿生纳米载体用于肿瘤化学免疫联合治疗。
IV总结与展望NDDS应用于肿瘤化学免疫联合治疗的研究充满机遇,同时也面临巨大挑战:
1)尽管NDDS在打破肿瘤免疫平衡、清除肿瘤、抑制肿瘤转移等方面具有优势,但肿瘤部位免疫治疗药物蓄积增多可能诱发自身免疫性疾病,增加iRAE的发生。
2)化疗药物和免疫治疗药物通常具有不同的靶细胞,NDDS co-encapsulation 策略通常难以实现对肿瘤组织中不同细胞的精准递送,这可能会增加药物脱靶效应。因此,合理设计定时定量释药的NDDS,实现不同药物精确靶向至不同细胞,是肿瘤化学免疫联合治疗研究的新方向。
3)由于工艺复杂、难以避免的药物泄露、辅料安全性问题、稳定性差等问题,NDDS的临床转化仍面临较大障碍。设计处方简单、制备工艺成熟、生物相容性好、易于工业生产的NDDS,仍是肿瘤治疗研究中的热点与难点。
本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。
| 温馨提示:苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。网站部分文献案例图片源自互联网,图片仅供参考,请以实物为主,如有侵权请联系我们立即删除。 |
下一篇: 纳米医学产品1


