Nature Communications | 不影响化疗效果且催化活性可调节的CeO2纳米颗粒阻止化疗引起的急性肾损伤
导语
急性肾损伤(AKI)作为肿瘤化疗引起的普遍且致命副作用,严重影响化疗的癌症病人。AKI主要表现为由ROS引起的肾细胞的相关损伤。降低ROS可以减少疗引起的AKI,与此同时也会降低化疗效果。小分子的抗氧化剂N-acetyl cysteine(NAC)是降低氧化损伤对抗化疗引起的AKI的一种方式;钼基多氧甲酸纳米团簇作为一种纳米抗氧化剂可在肾脏中聚集,用以有效保护肾脏;DNA origami的纳米结构也被证实具有ROS清除能力,用以保护肾脏结构并改善AKI。然而这类小分子和纳米材料的抗氧化作用也会降低肿瘤组织的氧化应激,将会刺激肿瘤的生长和转移,因而阻碍它们在化疗引起的AKI上的应用。
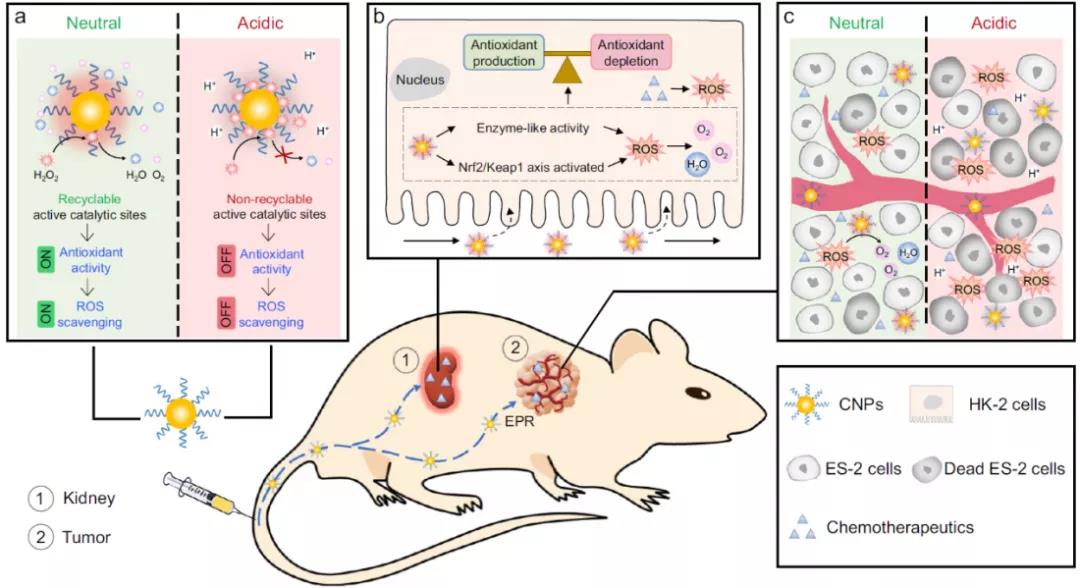
鉴于此,浙江大学凌代舜课题组在《Nature Communication》上发表了Catalytic activity tunable ceria nanoparticles prevent chemotherapy-induced acute kidney injury without interference with chemotherapeutics为题的研究,该研究设计了一种催化活性可调的二氧化铈纳米粒子(CNPs),可以防止化疗引起的 AKI,但不会干扰化疗作用。具体来说,在肾皮层中性环境中CNP催化分解H2O2,然后通过激活Nrf2/Keap1信号通路来调节与ROS有关的基因表达,恢复ROS平衡保护肾小管;在肿瘤酸性微环境下,CNP由于高浓度的H+破坏了其活性催化位点进而限制其的抗氧化作用,从而不干扰化疗生成的ROS来杀死癌细胞。作为 ROS调节剂,CNP这种条件依赖型可调的催化活性,在癌症患者的 AKI 临床预防和治疗方面具有巨大潜力。
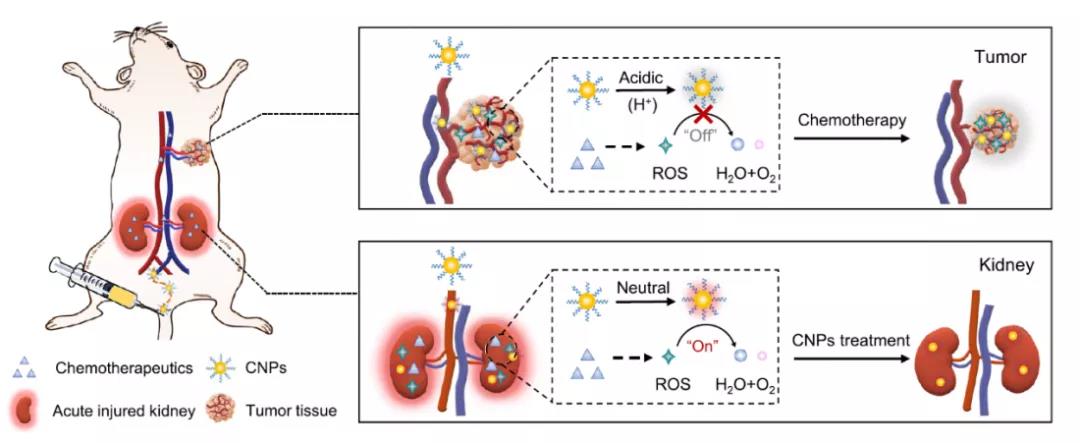
图1 CNPs在小动物体内不同组织中由于不同pH而显示出不同功能的示意图。
01
CNPs的合成和表征
研究者们采用一种改良的反向微胶团方法合成了直径约3 nm疏水CNPs,并且对其表现进行DSPE-PEG2K修饰。CNPs的水合动力学直径为9.7 nm,电势为-20.4 mV。XPS表明了Ce3+和Ce4+共存。CNPs引起H2O2的降解符合米氏动力学方程。Km在中性条件下比酸性条件下低1.4倍,Vmax高2.1倍。XRD结果表明CNPs可调节的活性不是基于晶体结构的改变。H2O2+2Ce4+→O2+2H++2Ce3++Vo,在酸性环境中Ce3+可以再回到Ce4+,重新形成活性位点,而非活化的CNP(iCNP),H2O2和H+渗透的CNPs失去抗氧化活性,且很难逆转。
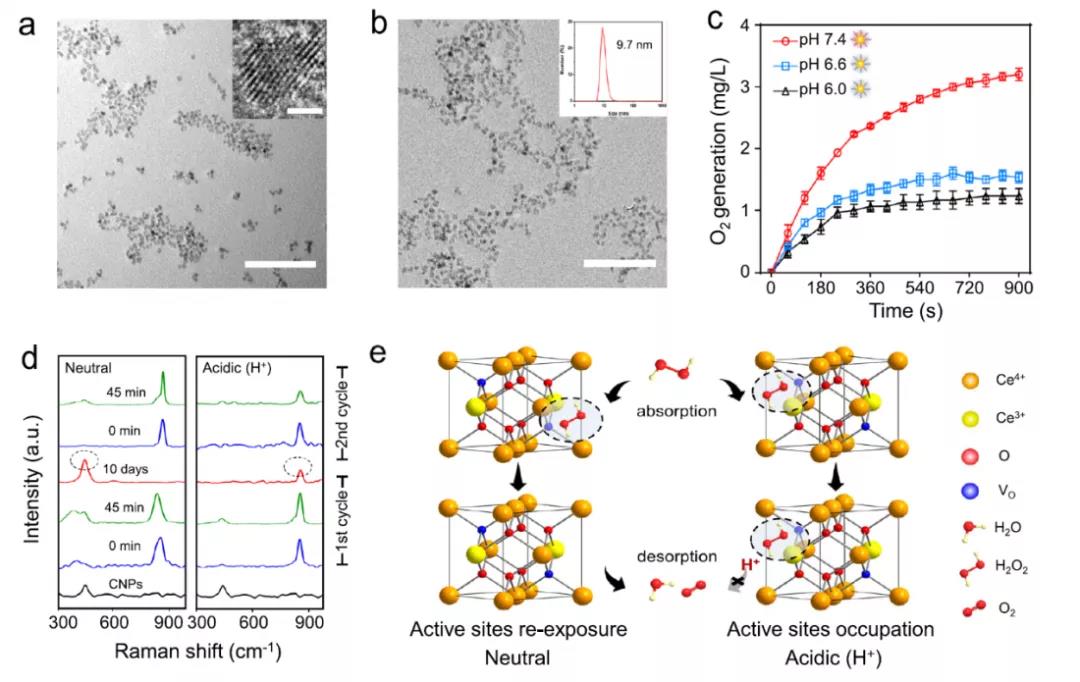
图1(a)氯仿中超微CNPs的TEM图像;(b)经DSPE-PEG修饰后的CNPs水相中TEM图像,其中内插图DLS数据表明DSPE-PEG水合直径分布为9.7nm;(c)CNPs在不同pH下分解H2O2的O2产生量;(d)在中性和酸性pH,CNPs与H2O2反应下其不用时间的拉曼光谱;(e)CNPs pH环境依赖性表现出的类过氧化氢酶活性差异的化学模型示意图。
02
CNPs条件依赖性的细胞保护效应
顺铂(DDP)是广泛使用的抗实体肿瘤药物,具有肾毒性,究其原因是肾上皮细胞是DDP诱导肾毒性的主要目标。使用HK-2细胞和ES-2细胞来研究CNPs对肾脏的pH依赖的保护作用,实验表明:在pH7.4时CNP明显降低了DDP诱导的细胞毒性,在pH=6.6或pH=6.0时却不受影响;而小分子抗毒剂NAC在pH=6.6时仍具有抗毒性。在其它肿瘤细胞和正常细胞中,如肿瘤细胞OVCAR8,HepG2,A549和正常的LO2细胞,CNPs均表现出pH依赖的抗DDP毒的细胞保护效应。此外CNPs在HK-2细胞和ES-2细胞中也具有pH依赖的抗紫杉醇细胞毒性的作用。
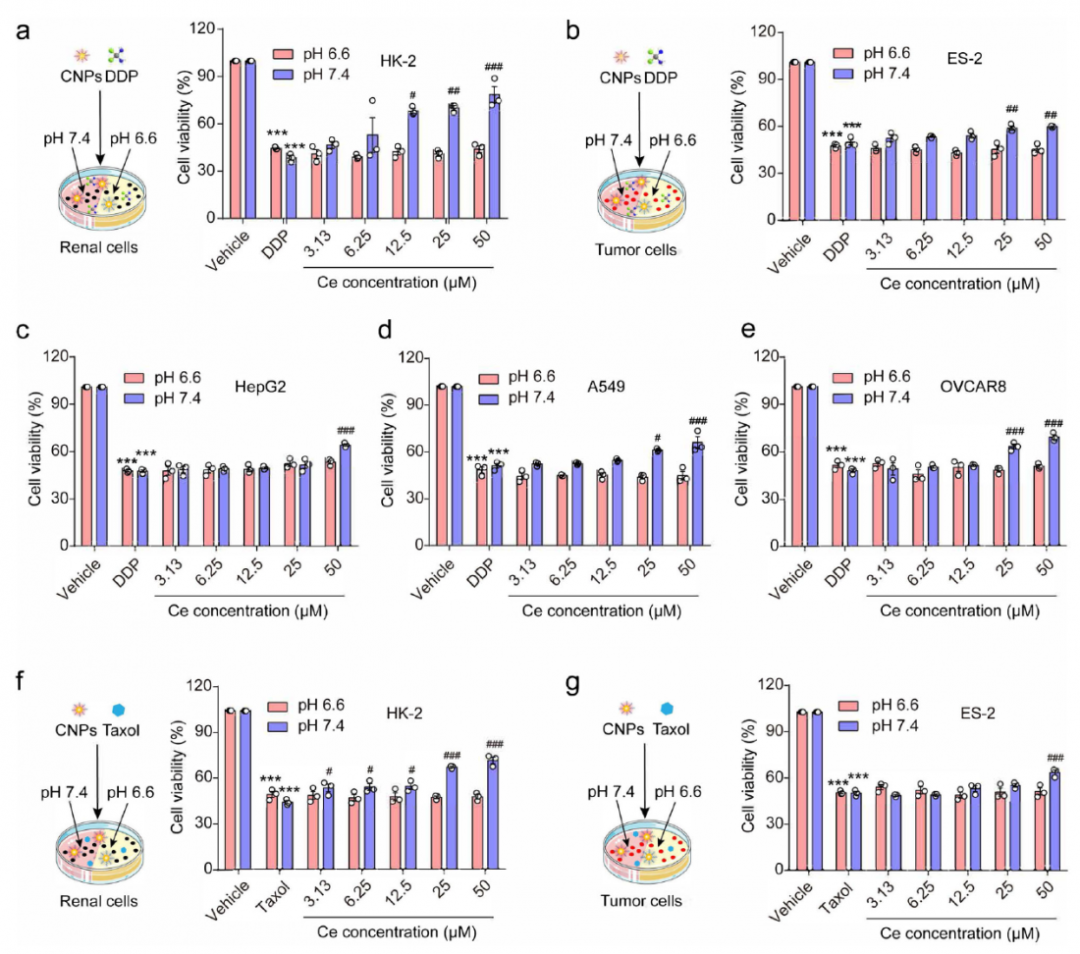
图2 (a-e) DDP处理,不同浓度的CNPs在不同pH条件下,对HK-2、ES-2、HepG2、A549以及OVCAR8存活率的影响;(f, g) 不同pH条件紫杉醇处理后HK-2和ES-2细胞的存活率。
03
体内水平CNPs对抗化疗引起的AKI作用分析
研究者们进一步研究了CNPs的药代动力学及其在小鼠体内的分布情况。组织学实验表明CNPs无明显的细胞毒性。ICR小鼠腹腔注射DPP诱导AKI,同时分别静脉注射生理盐水、CNPs和iCNP,与正常小鼠相比,AKI小鼠中CNPs积累增强,且在肾上皮中具有更长的保留时间。生物电镜显示,肾髓质中的肾小管上皮细胞纤毛、肾小球基底膜和肾小管上均存在CNPs。这可能与CNPs尺寸小(~3nm),PEG的可形变表面修饰,CNPs的表面负电荷和肾损伤的抗肾小球基底膜(GBM)渗透增强有关。在经治疗的小鼠的尿液中发现CNPs,这表明CNPs可通过GBM过滤到肾小管并通过尿液排出。包膜窖介导的胞吞作用在CNPs的摄取中发挥着重要作用。与肾损伤相关的血清血尿素氮(BUN)和肌氨酸(Cre)以及KIM-1的mRNA,在注射CNPs后的AKI小鼠中均表现为下降,H&E染色显示CNPs治疗有助于改善DDP治疗的肾损伤。
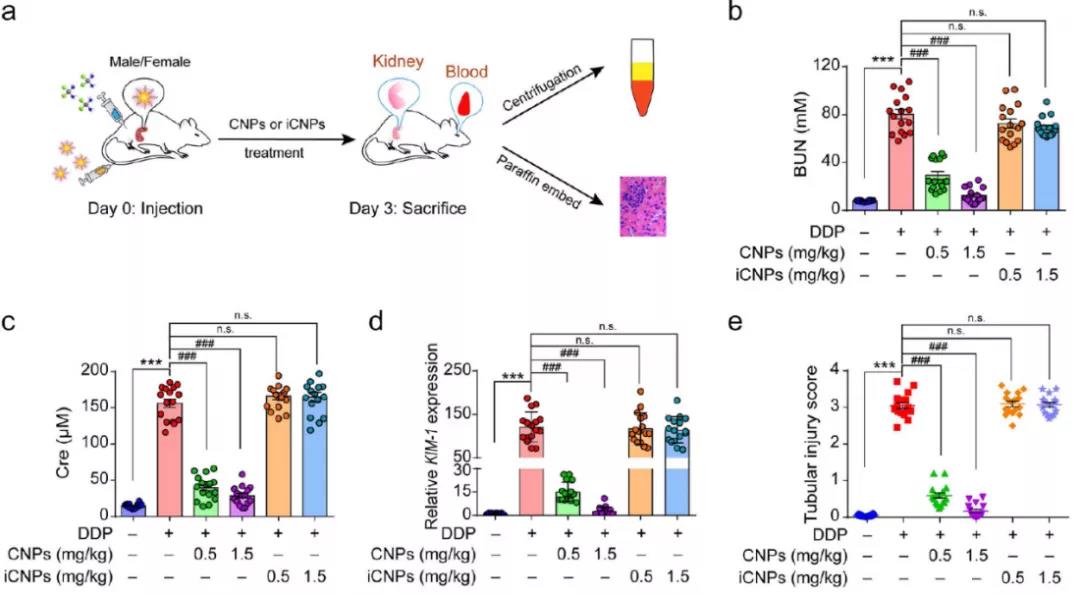
图3 (a) AKI小鼠治疗处理和评估的示意图;(b, c和d) 不同处理后BUN、Cre和KIM-1相关基因表达情况;(e) 不同处理后肾小管的损伤程度分析。
04
CNPs在AKI中的抗凋亡作用
研究者们通过CNPs对于细胞凋亡信号的影响,来探索CNPs减轻AKI的机理。经DDP处理后,HK-2细胞凋亡率、PARP和caspase-3表达显著增加,但再经CNPs处理后这些相关因素显著下降。因而认为CNPs可显著降低DDP引起的TUNEL凋亡水平。ROS是诱导凋亡的关键因素,CNPs可以清除DDP诱导的内源ROS,逆转DDP对于SOD的抑制和MDA的升高。qRT-PCR分析表明CNPs可以降低DDP处理后的HO-1基因表达,提高NOX2基因表达,使它们的表达接近无DDP处理的原始水平。
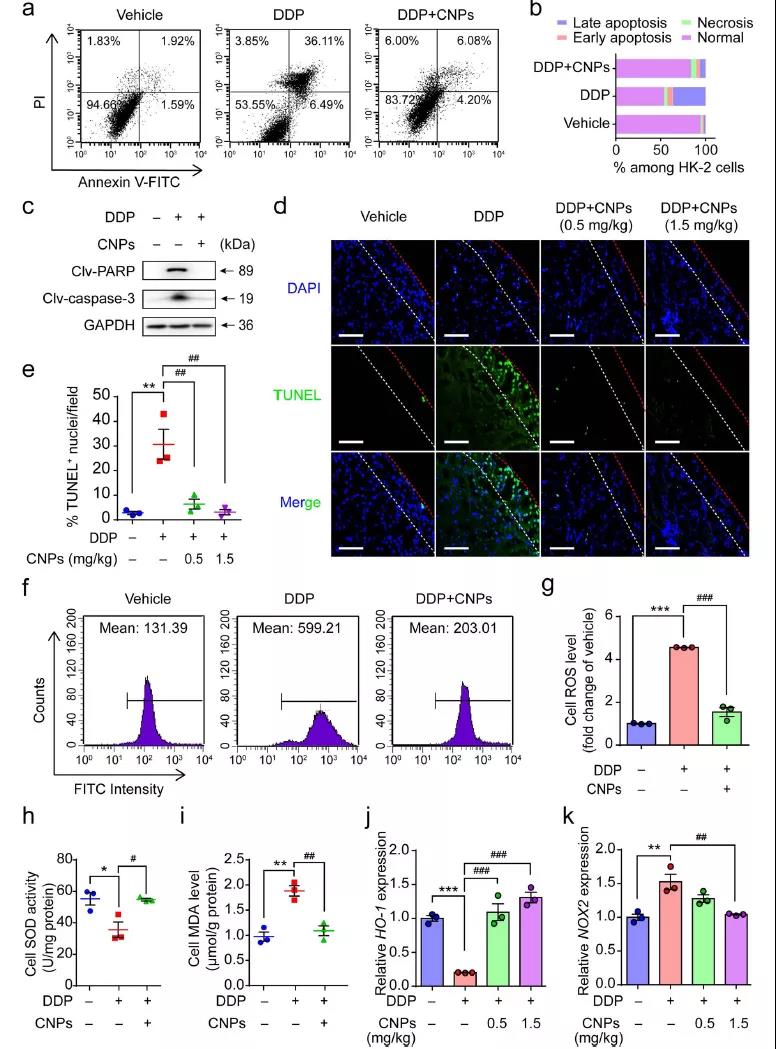
图4 (a)细胞凋亡流式检测分析;(b) HK-2细胞中各种状态的细胞进行量化;(c)蛋白印迹分析PARP和caspase-3表达情况;(d, e) TUNEL水平的染色图和图表;(f, g) HK-2细胞中ROS的流式细胞分析图和图表;(h-k) SOD活性,MDA水平,HO-1和NOX2相关基因表达情况。
05
CNPs对AKI保护效应的分子机制分析
Nrf2是ROS信号调控通路中的主要调控因子(ROS增多时,其表达减少),研究者利用western bolt检测了CNPs处理前后Nrf2及相关蛋白DJ-1和Keap1的表达情况,发现DJ-1和Nrf2表达上调,Keap1表达下调。Nrf2的敲除则会消除CNPs对于DDP产生的AKI的保护作用,也不能抑制凋亡相关的PARP和caspase-3表达水平,抗氧化类基因也对CNPs不再敏感。这些实验结果均表明CNPs通过激活Nrf2降低ROS,并因此阻止细胞凋亡,实现对于肾细胞的保护。
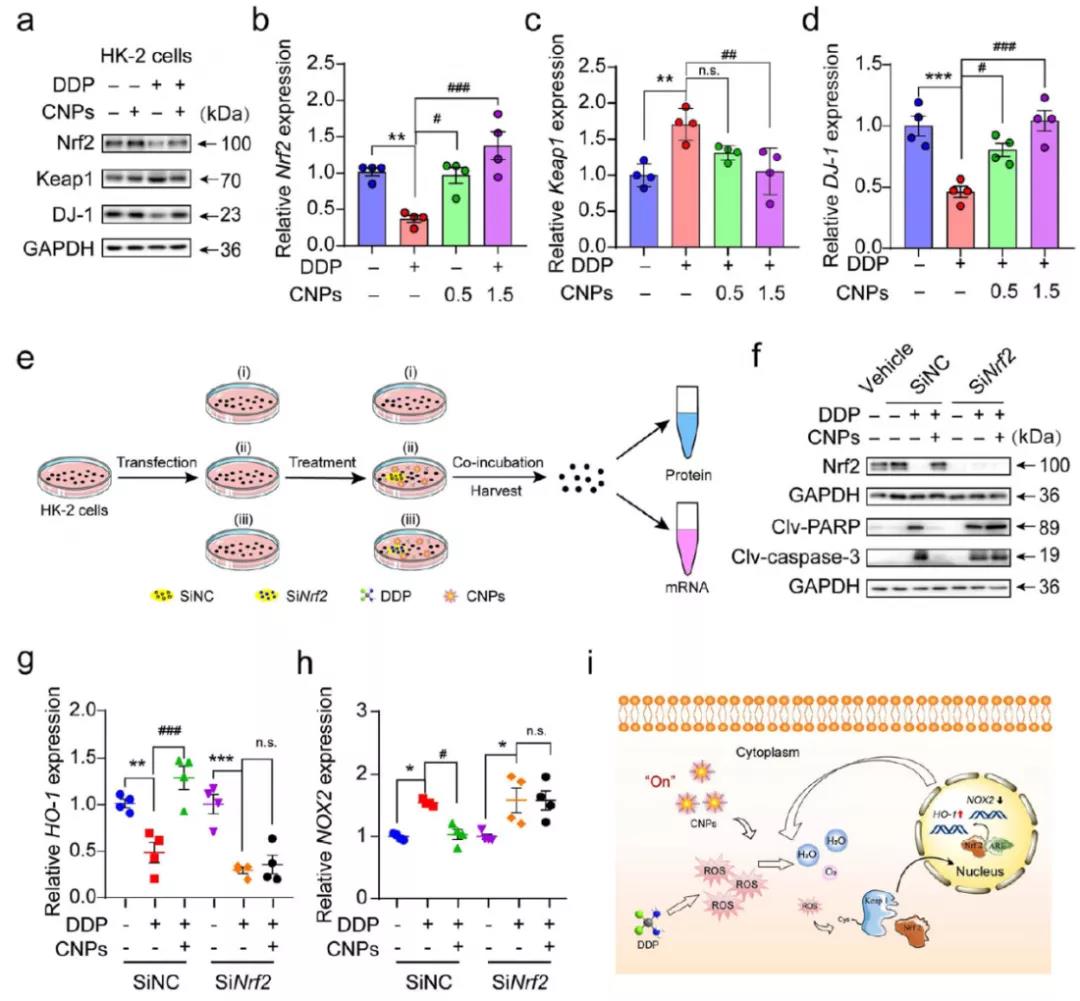
图5 (a, b-d) 经不同处理后HK-2细胞中的Nrf2, Keap1和DJ-1蛋白质印迹分析及量化;(e-h) 利用小干扰RNA负调Nrf2后通过western blot和qRT-PCR分析相关基因的表达情况;(i) CNPs通过激活Nrf2/Keap1,对抗DDP引起的氧化应激的细胞内信号转导示意图。
06
CNPs对于体内总体化疗效果的提高
相对于小分子药物NAC(在肿瘤中也提高SOD活性,降低MDA水平)经CNPs(在肿瘤中不改变SOD活性和不降低MDA水平)处理的荷瘤小鼠,治疗期间小鼠体重变化波动较小,且死亡率降低,能够更大程度上增强化疗药物对肿瘤治疗作用同时降低化疗毒副作用。
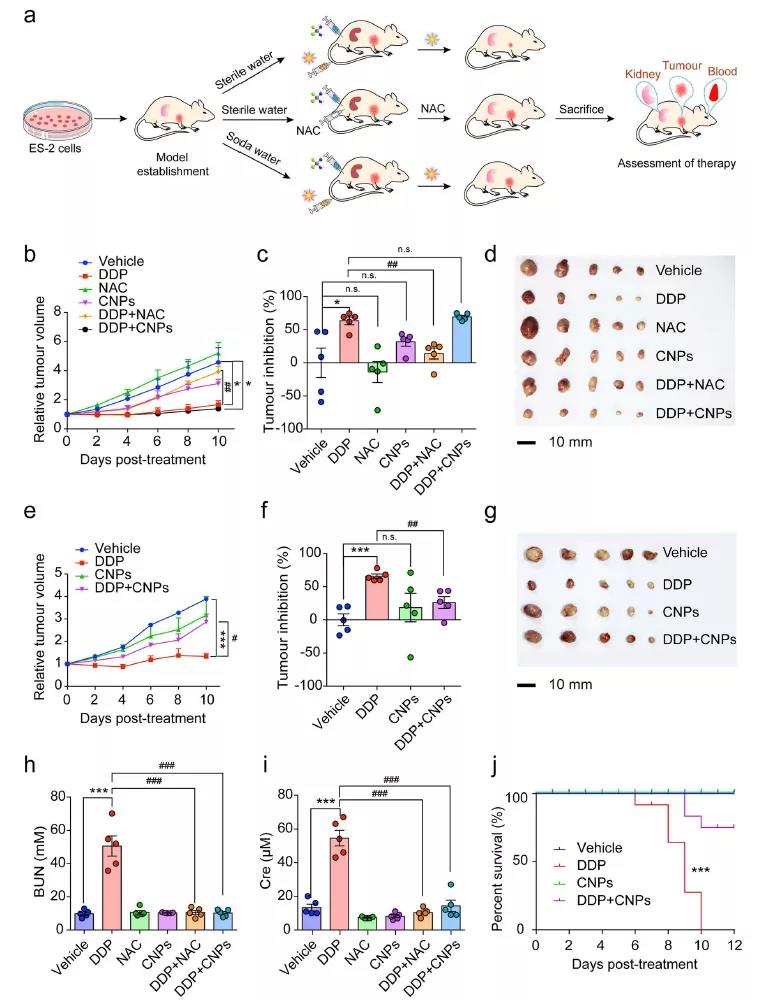
图6 (a) ES-2皮下瘤小鼠治疗方式与评估示意图;(b-g)不同处理的肿瘤体积、抑制效率和实体肿瘤大小;(h, i)不同处理下小鼠的BUN和Cre的水平以及(j)不同处理下小鼠的存活率。
总结展望
综上所述,AKI是一种与ROS相关的高死亡率的疾病,是化疗产生的一种常见的毒副作用。小分子的抗氧化剂(NAC)在减弱AKI的同时,也会降低化疗效果。基于pH依赖性活性可调的CNPs,在pH中性的正常细胞环境可以分解表面吸附的H2O2,重新暴露出CNP的活性催化位点以进行下一轮的循环,从而降低了细胞中的ROS,减少了细胞的凋亡,降低了化疗药物的毒副作用;而在pH酸性的肿瘤细胞环境中,其表面吸附的H2O2反而会破坏活性催化位点的再暴露,阻止了其对ROS的清除,而不降低化疗药物的肿瘤杀伤能力。CNPs对于中性pH细胞的保护,是通过激活Nrf2/Keap1信号通路,进而提高SOD活性,提高抗氧化类基因的表达,调控细胞凋亡以及相关蛋白表达,从而达到降低ROS,减少细胞凋亡,减少肾损伤的作用。因此,CNPs有望扩大化疗的使用,让更多癌症病人从中获益。
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
| 温馨提示:苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。网站部分文献案例图片源自互联网,图片仅供参考,请以实物为主,如有侵权请联系我们立即删除。 |
下一篇: 生物微球


