乳腺癌
Adv. Sci. 2022:酸降解产氢MOF材料克服癌症耐药/转移和脱靶副作用

背景
开发既能控制药物释放又具有高生物安全性的刺激响应性可降解多孔载体对其临床转化至关重要,但目前仍具有挑战性。本文通过卟啉与零价铁原子的配位,设计了一种新型的卟啉-铁金属有机骨架(Fe-MOF)纳米晶体,作为酸降解的药物载体和氢供体。Fe-MOF纳米晶体表现出优异的酸响应降解能力,可以产生氢气并同时释放负载药物,用于癌症多药耐药(MDR)和转移的氢联合化疗,以及局部氢消除药物对正常细胞/组织的脱靶毒副作用。在机制上,释放的H2通过免疫激活瘤内M1表型巨噬细胞,从而下调转移相关基质金属蛋白酶-2 (MMP-2)的表达,帮助化疗药物有效抑制肿瘤转移,并下调MDR癌细胞中p -糖蛋白(P-gp)蛋白和三磷酸腺苷(ATP)的表达,使化疗药物增敏,增强对线粒体和DNA的损伤。高抗MDR/抗转移性和高生物相容性使Fe-MOF纳米晶体和基于Fe-MOF的纳米药物具有很高的临床转化潜力。
图文导读
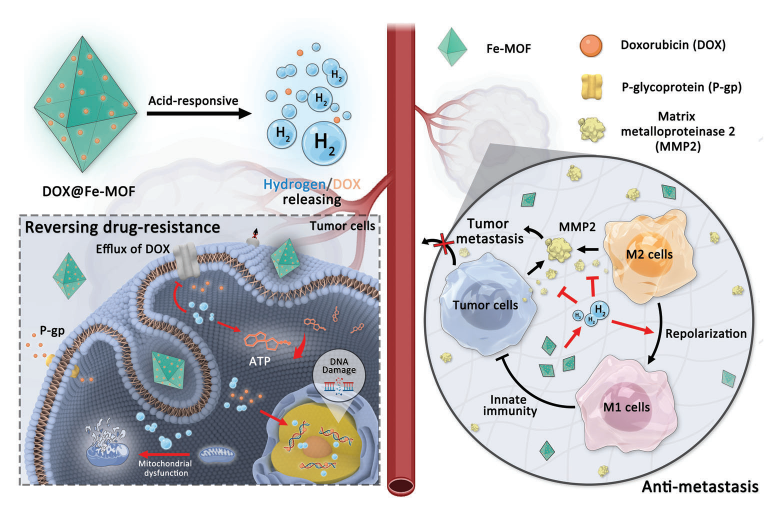
(图1 从DOX@Fe-MOF纳米晶体中释放酸反应性氢/药物以克服癌症耐药/转移的示意图)
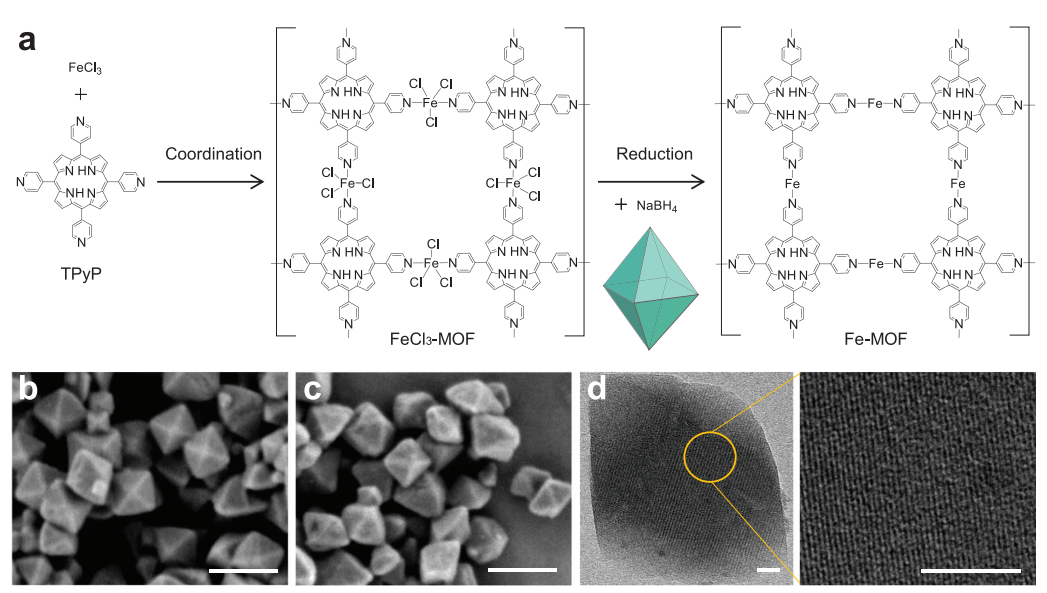
(图2 Fe-MOF纳米晶的合成路线及形貌和结构)
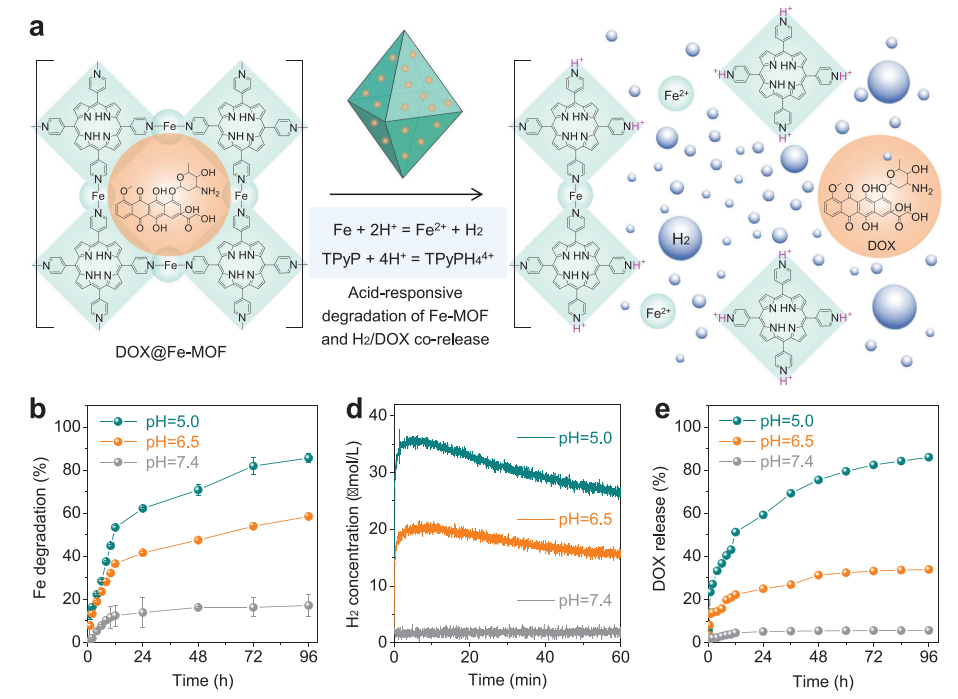
(图3 酸反应性降解和氢/药物释放谱)
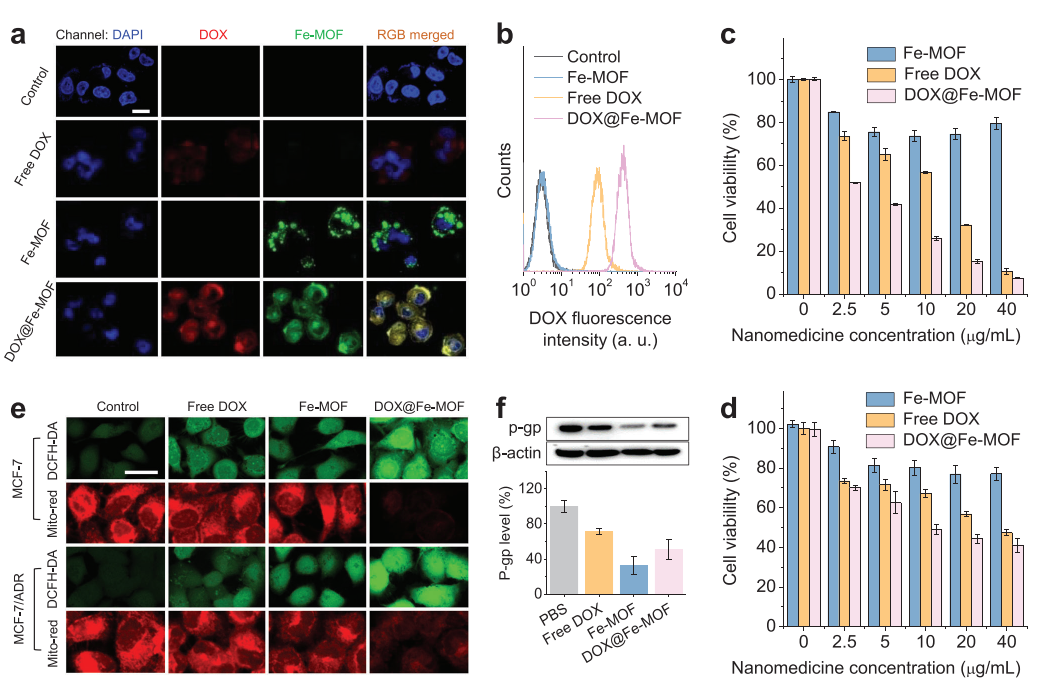
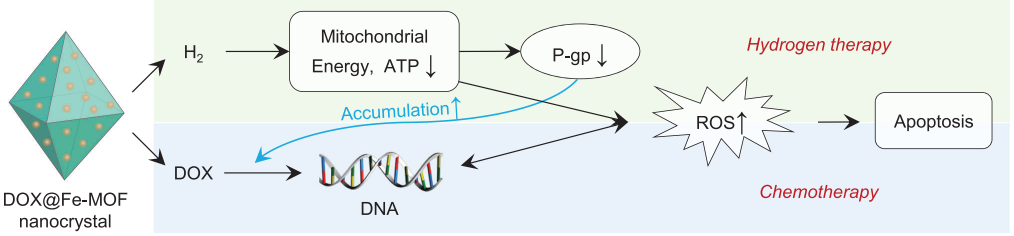
(图4 体外氢联合化疗治疗癌症耐多药的疗效及机制研究)
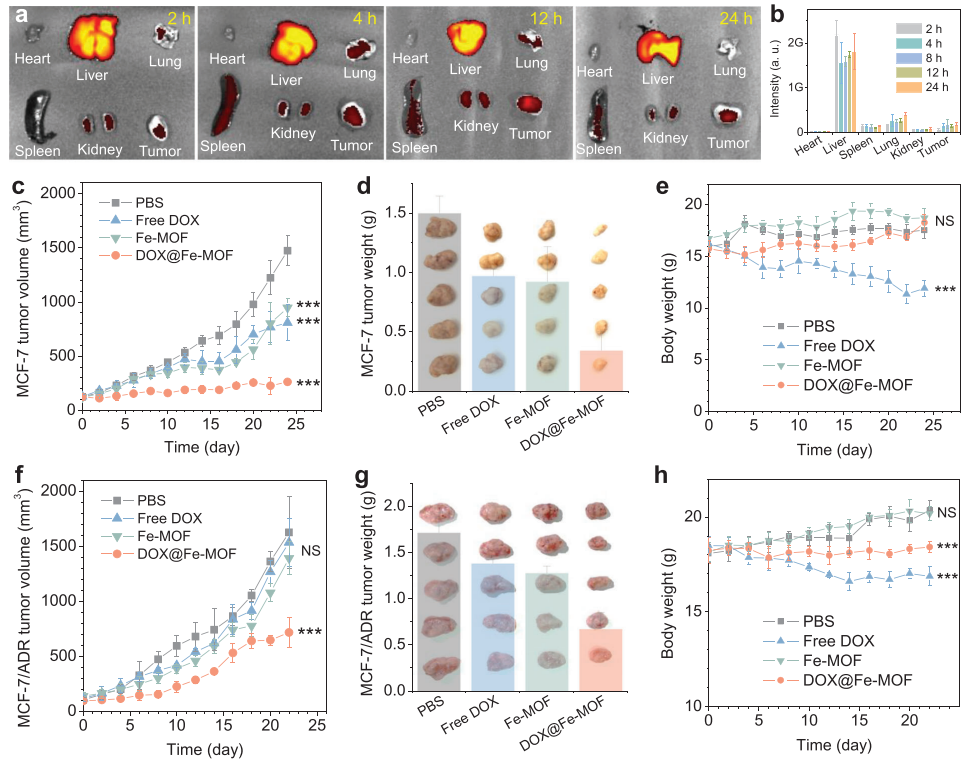
(图5 体内氢联合化疗(n = 5个独立实验))

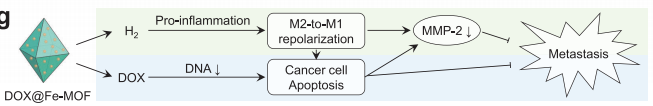
(图6 DOX@Fe-MOF纳米药物对原发性乳腺肿瘤生长和肺转移的抑制作用)
全文总结
开发了一种新型的Fe-MOF纳米晶体作为耐多药和转移的氢联合化疗的药物载体和氢供体。所构建的DOX@Fe-MOF纳米药物具有优异的酸响应降解和氢/药物释放行为。纳米药物释放的氢气通过下调P-gp表达和降低ATP水平,增强ROS介导的DNA损伤,有效增敏MCF-7/ADR细胞的化疗,并通过免疫激活M1巨噬细胞和抑制MMP-2表达,辅助DOX有效抑制转移。另一方面,纳米药物释放的氢气也减少了DOX对正常组织的毒副作用,使DOX@Fe-MOF纳米药物具有良好的生物相容性和生物安全性。高抗MDR和抗转移效果和高生物安全性得益于DOX@FeMOF纳米药物优异的通用性Fe-MOF平台,保证了其临床转化的高潜力。
原文链接:https://doi.org/10.1002/advs.202101965
仅用于学术分享,侵权请联系删除,欢迎交流。
| 温馨提示:苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。网站部分文献案例图片源自互联网,图片仅供参考,请以实物为主,如有侵权请联系我们立即删除。 |
上一篇: 软骨缺损修复


