同济蔡明/上交大崔文国《ACS Nano》微流控明胶水凝胶微球捕获镁离子促进松质骨再生
【摘要】
最近,受磁铁吸引金属的启发,同济大学蔡明副教授/上海交通大学崔文国教授团队共同利用金属离子配体的配位反应构建了双膦酸盐功能化可注射水凝胶微球(GelMA-BP-Mg),该微球可以通过捕获 Mg2+ 促进骨质疏松性骨缺损的松质骨重建。通过在 GelMA 微球上接枝双膦酸盐 (BP),GelMA-BP 微球可以通过配位反应产生强大的 Mg2+ 捕获能力和缓释性能,而缓释 BP 具有骨靶向特性。在可注射的 GelMA-BP-Mg 微球系统中,捕获的 Mg2+ 的原子百分比为 0.6%,捕获的 Mg2+ 可以有效释放 18 天。
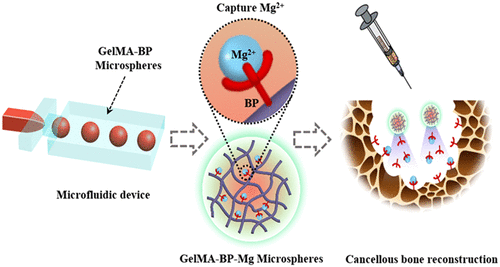
这些证明复合微球能够有效地捕获Mg2+,为复合微球激活成骨细胞和内皮细胞并抑制破骨细胞提供了基础。体内外实验结果表明,磁铁激发的Mg2+捕获复合微球通过刺激成骨细胞和内皮细胞同时抑制破骨细胞,有利于成骨和血管生成,最终有效促进松质骨再生。该研究可为基于金属离子治疗骨质疏松性骨缺损提供一些有意义的思路。相关论文以题为Capturing Magnesium Ions via Microfluidic Hydrogel Microspheres for Promoting Cancellous Bone Regeneration发表在《ACS Nano》上。
【图文解析】
受磁铁吸引金属的自然现象启发,团队通过席夫碱反应和配位键在甲基丙烯腈酰化明胶(GelMA-BP)微球表面螯合Mg2+,以构建一种捕获 Mg2+ 微流体水凝胶微球(GelMA-BP-Mg)受磁铁启发,赋予水凝胶微球主动捕获 Mg2+、微创注射性、持续缓释特性和骨靶向能力,从而增强其激活成骨细胞和 内皮细胞和抑制破骨细胞,最终通过“集成多用途”微球实现松质骨的重建(示意图1)。
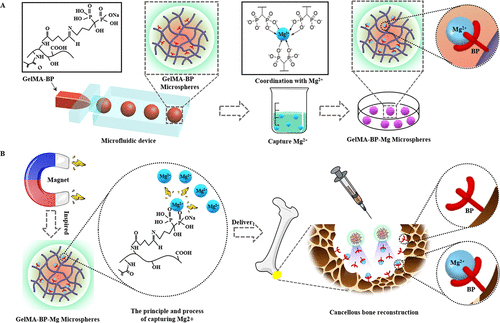
示意图 1. (A) 微流体 GelMA-BP 微球的制备过程和捕获 Mg2+的 GelMA-BP-Mg 微球的构建。(B) 具有“磁铁”功能的可捕获Mg2+的微流控GelMA-BP-Mg微球的构建及捕获Mg2+的原理描述。
复合微球的制备与表征
SEM显示GelMA-BP-Mg微球表面存在平均粒径为79±15nm的BP-Mg纳米颗粒,而GelMA-BP和GelMA微球表面不存在这种纳米结构(图1A)。能量色散 X 射线光谱 (EDS) 显示 GelMA-BP 微球具有均匀的 P 元素分布,GelMA-BP-Mg 微球具有均匀的镁元素分布(图 1B)。此外,对于每组复合微球样品,EDS 显示SEM 观察到的 GelMA-BP 和 GelMA-BP-Mg 中存在相应的 P 元素和 Mg 元素(图 1C)。31P NMR谱(图1D)显示只有GelMA-BP和GelMA-BP-Mg在17.6ppm处有明显的共振峰。图1E显示了BP的累积释放曲线。可以观察到,在 GelMA-BP 和 GelMA-BP-Mg 微球药物释放后的 12 天内,BP 的释放速度较快,然后逐渐减慢。发布21天后,BP的发布趋于持平。图 1F 显示了 GelMA-BP-Mg 微球的 Mg2+ 累积释放曲线。图 1G 显示系统中形成粒径为 77±12 nm 的 BP-Mg 纳米粒子,与图 1G 中 SEM 显示的 GelMA-BP-Mg 微球表面纳米粒子基本相同。图 1H 显示了制备可捕获 Mg2+ 的复合微球所涉及的化学方程式。

图 1. 复合微球的特性。(A) GelMA、GelMA-BP 和 GelMA-BP-Mg 微球在不同放大倍数下的典型扫描电子显微镜图像。(B) 双膦酸盐在 GelMA-BP 微球上的均匀分布以及双膦酸盐和捕获的 Mg2+ 在 GelMA-BP-Mg 微球上的均匀分布。(C) 能谱分析,证实复合微球上存在相应的 P 和 Mg 元素。(D) 三种复合微球的 31P 核磁共振谱。(E, F) 复合微球 BP 和 Mg2+ 的释放曲线,证明了 BP 的成功接枝和 Mg2+ 的有效捕获。(G) MgCl2 溶液、BP 溶液以及 MgCl2 和 BP 混合体系的 TEM 图像。(H) 制备可捕获 Mg2+的复合微球所涉及的化学方程式。
复合微球体外生物相容性
首先在24孔板中培养BMSCs和HUVECs细胞,然后用GelMA、GelMA-BP、GelMA-BP-Mg微球共培养BMSCs和HUVECs细胞。根据 1、3 和 5 天的活/死染色结果,复合微球对共培养的 BMSC 和 HUVEC 的毒性较小(图 2AB、DE)。此外,CCK-8 结果进一步定量验证了每组之间的细胞增殖活性(图 2C、F)。定量统计分析表明复合微球具有良好的生物相容性。图 3 和图 S5A、B 的面板 A-E 是 BMSCs 和 HUVECs 细胞与 GelMA、GelMA-BP 和 GelMA-BP-Mg 微球共培养 2、5 和 7 天的结果,以及定量分析 进行了细胞数。因此,这些结果表明,每组复合微球都具有良好的生物相容性。
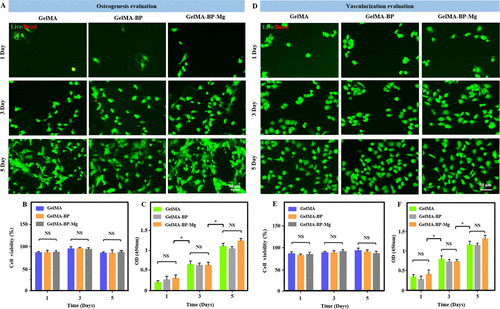
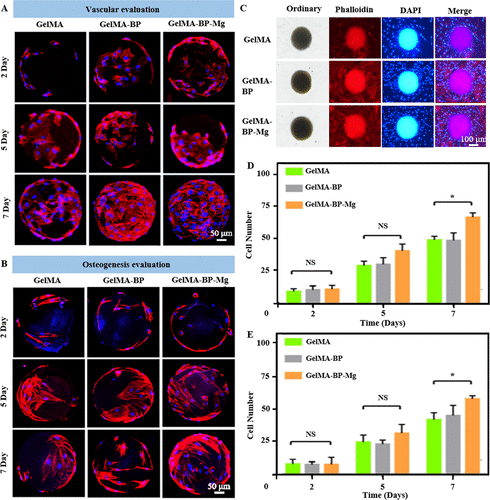
图 3. 复合微球的生物相容性。
(A, B) BMSCs 和 HUVECs 细胞在复合微球上的增殖行为,观察了 2、5 和 7 天。(C)复合微球和细胞的共培养。红色显示骨架;蓝色显示核。(D)微球上细胞数的统计。
成管实验
图 4A 显示,在给定的时间点,HUVEC 在每组复合微球样品的提取物中培养。3小时和6小时后,GelMA-BP-Mg组的管形成更好,与GelMA-BP和GelMA组形成鲜明对比,表明复合微球释放的Mg具有一定的血管生成活性。ImageJ 用于计算结的数量和形成的管的总长度。因此,结果表明,GelMA-BP-Mg 组的这些计算参数高于 GelMA-BP 和 GelMA 组,并且具有统计学意义(图 4B、C)。
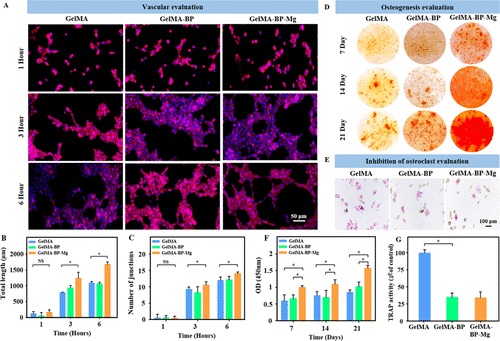
图 4. 复合微球的体外血管化、体外矿化和破骨细胞抑制。(A) 经过 1、3 和 6 小时的培养,HUVEC 细胞形成内皮网络。(B, C) 分析组间总长度 (B) 和节点数 (C) 的差异。(D) 不同微球复合物的骨髓间充质干细胞用茜素红 S 染色的照片。(E) 不同微球复合物中破骨细胞的 TRAP 染色显微镜图片。(F, G) 不同组茜素红 S 染色和 TRAP 染色的定量分析。
Q-PCR 和蛋白质印迹评估
培养 24 小时后,GelMA-BP-Mg 组中 VEGF 和 e-NOS 的表达水平显着高于 GelMA-BP 和 GelMA 组(图 5A、B、E-G)。因此,这些结果证明团队的复合GelMA-BP-Mg 微球可以有效地释放 Mg2+以激活 e-NOS 和 VEGF 途径,从而促进血管再生。
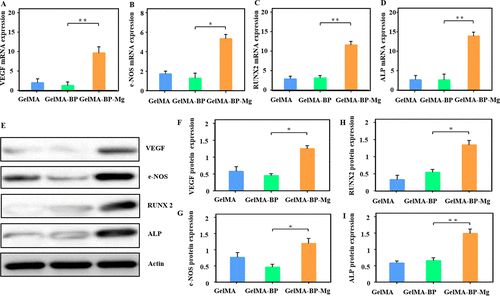
图 5. 复合微球对 BMSCs 和 HUVECs 细胞中成骨基因和管基因表达的影响。(A-D) Q-PCR 显示相关的 mRNA 表达。这些基因包括 Runx2、ALP、VEGF 和 e-NOS。(E-I) 蛋白质印迹探索蛋白质表达并进行定量分析。
复合微球体内骨再生评估和体内Mg2+捕获性能
如图 6A 所示,sham 组和 GelMA 组在 4 周和 8 周后没有明显的骨再生,而 GelMA-BP 和 GelMA-BP-Mg 的骨质量有一定程度的改善。最后,注射 GelMA-BP-Mg 的骨骼的 Tb.Th、BV/TV 和 BMD 显着高于 GelMA 和 GelMA-BP 组(图 6B-H)。EDS 显示从骨缺损中获得的 GelMA-BP 微球在 1 周和 2 周后在表面具有 Mg2+ 分布(图 6I)。因此,结果证明 GelMA-BP 微球仍然可以有效地捕获体内的 Mg2+。
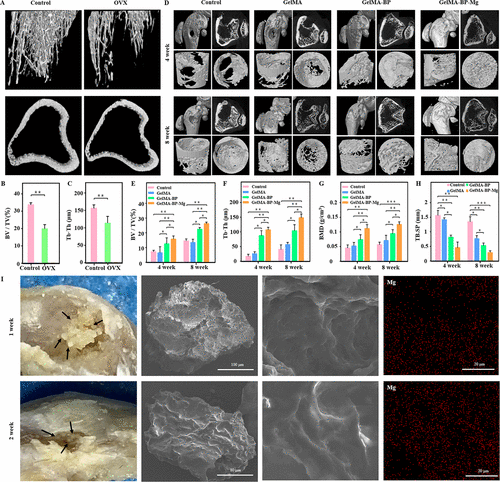
图 6. Micro-CT 评估了可注射复合微球对体内骨再生的影响。(A-C) 骨质疏松大鼠模型成功建立和定量分析。4 周和 8 周时骨质疏松性骨缺损大鼠股骨远端的典型显微 CT 图像。(E-H) 不同治疗组微 CT 参数的定量分析:(E) Bv/Tv、(F) Tb.Sp、(G) BMD 和 (H) Tb.Sp。(I) GelMA-BP微球注入骨缺损1周和2周后,EDS显示微球表面Mg2+分布,证明GelMA-BP微球可有效捕获体内Mg2+。
组织学评估
HE染色进一步验证了复合微球促进松质骨再生的能力(图7A、B)。CD31免疫荧光用于测试每组的第四周切片(图7C,D)。团队还通过I型胶原蛋白的免疫组织化学染色对骨缺损处新形成的骨组织进行了组织学分析(图7E,G),和结果与其他研究相似。定量分析结果显示,对照组骨缺损仍较明显,而注射GelMA-BP和GelMA-BP-Mg微球组的松质骨重建较多。特别是注射GelMA-BP-Mg微球的大部分缺陷都可以治愈。因此,微球复合物具有优异的成骨作用,与 GelMA-BP 和 GelMA 相比,GelMA-BP-Mg 具有更强的松质骨再生能力。
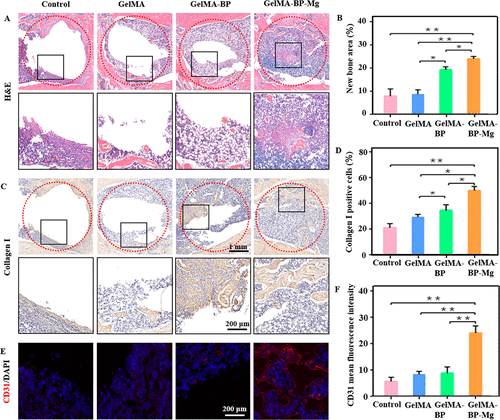
图 7. 复合微球体内治疗的组织学分析。(A)每组治疗 8 周的骨组织切片 HE 染色的代表性图片。(B)不同组中小梁骨面积的百分比。(C)手术后 8 周拍摄的股骨组织切片的代表性图片,用于I型胶原蛋白的免疫组织化学染色。(D) I 型胶原阳性细胞的定量。(E, F) 每组 CD31 表达变化的免疫荧光染色,以及蛋白质表达差异的量化。
【总结】
受磁铁吸引金属的自然现象的启发,该团队通过席夫碱反应性和配位键螯合了接枝BP的GelMA-BP微球表面的Mg2+。因此,构建了一种具有“磁铁”功能的可捕获Mg2+的微流控GelMA-BP-Mg微球,赋予水凝胶微球主动捕获Mg2+、微创注射性、持续缓释特性和骨靶向能力,从而增强其激活成骨细胞和内皮细胞以及抑制破骨细胞的能力,最终通过“一体化多用途”微球实现松质骨的重建。显然,在 GelMA 微球上接枝 BP 使 GelMA-BP 微球具有强大的 Mg2+捕获性能和缓释性能。GelMA-BP-Mg 复合微球在体外实验中显示出优异的 Mg2+捕获和释放性能、血管化能力、成骨潜力和破骨细胞抑制能力。进一步证明捕获Mg2+的复合微球可促进大鼠骨缺损处松质骨的再生。团队相信这种基于“磁铁”这一自然现象能够捕获Mg2+的复合微球,将为临床骨质疏松性骨缺损修复提供一个有意义的概念。
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
| 温馨提示:苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。网站部分文献案例图片源自互联网,图片仅供参考,请以实物为主,如有侵权请联系我们立即删除。 |
下一篇: 纳米医学产品1


