骨肿瘤疗修的生物玻璃支架材料:3D打印超薄二维碳化铌MXene纳米片
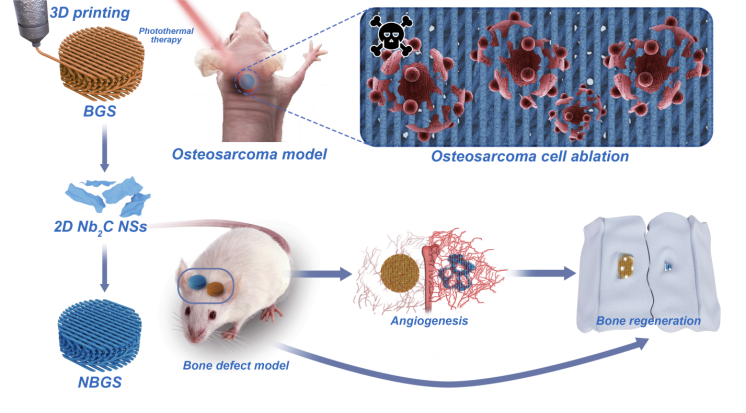
骨肿瘤术后复发和肿瘤切除后继发骨缺损是临床医生面临的棘手问题。同时具有肿瘤消融和诱导骨再生能力的多功能生物疗修材料(兼具治疗和修复功能)有望开发用于临床骨肿瘤治疗。二维碳化铌(Nb₂C) MXene具有良好的生物相容性和生物可降解性,在第二近红外(NIR-II)生物窗口中具有固有的光响应和光热转换性能。本工作将2D Nb₂C MXenes整合到3D多孔生物玻璃支架中,实现了光热热疗杀死骨肿瘤细胞及血管化驱动新骨形成的多重功能,为骨肿瘤治疗提供了一种新型生物疗修支架材料。
本文亮点
1. 采用2D碳化铌MXene纳米片复合3D打印生物玻璃支架,实现兼具光热治疗和骨修复功能的生物复合支架材料的制备。
2. 该生物复合支架材料实现了NIR-II生物窗下骨肉瘤的高效光热消融。
3. 该生物复合支架材料具备良好的骨传导性和骨诱导性,能够驱动缺损部位血管化并促进骨再生。
内容简介
早期手术切除和化疗是治疗骨肿瘤的常用方法,但预防复发和填补切除部位引起的骨缺损仍具有较高的挑战性。上海交通大学附属第六人民医院高俊杰,张长青等;上海大学陈雨等在本文中报道了一种近红外光激发的二维超薄碳化铌MXene纳米片复合到3D打印的生物玻璃支架(NBGS)用于治疗骨肉瘤的方法。集成的2D Nb₂C-MXene在第二近红外(NIR-II)生物窗中具有光响应及较高的组织穿透深度,使其能够有效杀伤骨癌细胞。此外,该材料能明显促进血管新生。支架降解过程中释放的钙和磷酸盐可以促进新骨组织的矿化。具有杀伤骨肿瘤细胞、促进血管新生和骨再生等多种功能的碳化铌MXene复合支架是一种对骨肿瘤有较好疗效的植入性生物疗修材料。
图文导读
I 2D Nb₂C MXene NSs的合成与表征
采用化学剥离法制备2D Nb₂C MXene NSs。SEM图像显示,固相烧结制备的Nb₂AlC陶瓷(MAX相)具有致密的层状组织。如图1所示,SEM图像和对应的元素含量表明,该MAX相陶瓷为Nb、Al和C三元化合物(图1b)。用HF处理后,形成了多层结构(MXene),Al含量明显降低(图1d)。经过TPAOH的进一步插入,得到了少层的Nb₂C NSs。与Nb₂AlC相比,Nb₂C NSs中Nb元素的信号强度显著增强,而Al元素的信号强度降低。与XPS数据一致,拉曼光谱显示元素Al在Nb₂C中的NSs比Nb₂AlC粉中的损失显著。经过HF和TPAOH处理后,Nb₂CNSs显示出层状结构。
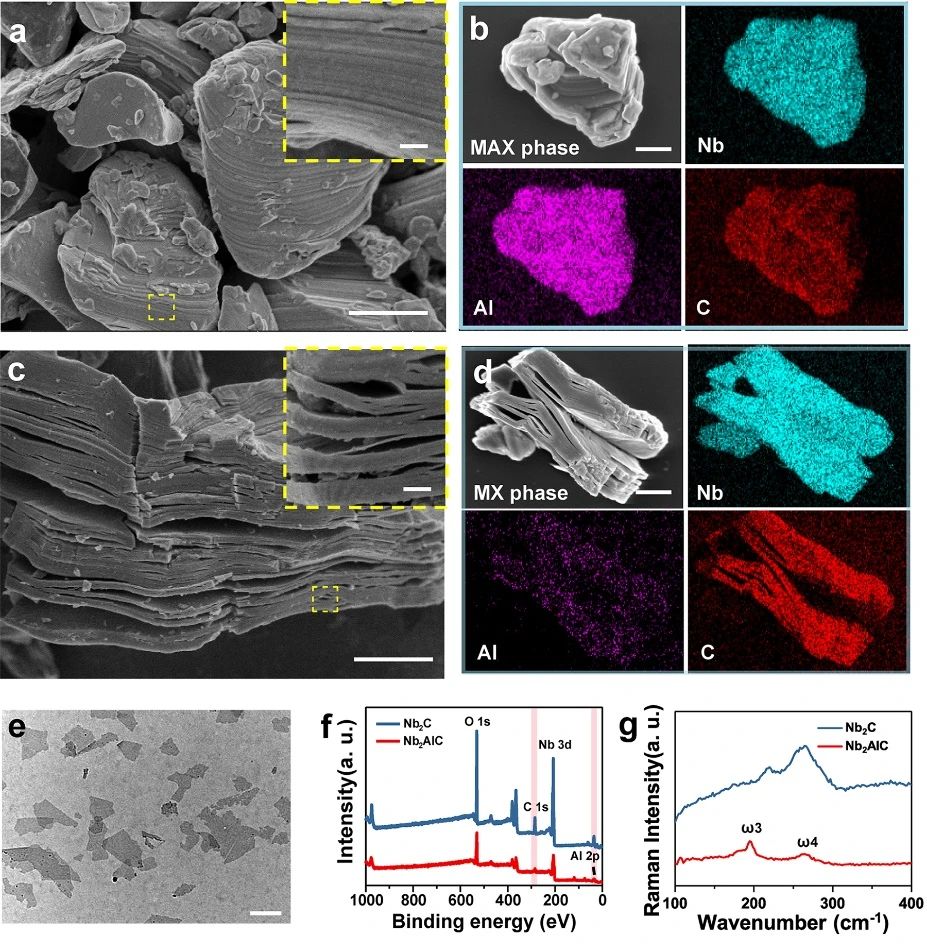
图1. 超薄2D Nb₂C MXene NSs的制备与表征。(a-b) Nb₂AlC陶瓷对应元素(Nb、Al和C)的SEM图像;(c-d) 多层Nb₂CMXene及其对应元素(Nb、Al和C)的SEM图像;(e) 超薄Nb₂C MXene NSs的TEM图像;(f) Nb₂AlC和Nb₂CNSs的X射线光电子能谱(XPS);(g) Nb₂AlC体和Nb₂C NSs的拉曼光谱。
II 3D NBGS的合成与表征
直观上看,从BGS、0.25 NBGS、0.5 NBGS到1.0 NBGS,支架的颜色由白色逐渐变为黑色,但在Nb₂C NSs改性过程中,其3D清晰的微孔结构没有发生变化。此外,随着Nb₂C NSs浓度的升高,Nb₂C NSs在NBGS表面相应增加,而微孔减少。NBGS的截面形貌和放大的界面SEM图像表明Nb₂C NSs和BGS的成功整合。

图2. 3D NBGS的合成与表征。(a-d) 具有三维几何结构的BGS和NBGS的数码照片;(e-p) 不同放大率的SEM图像;(q) BGS和NBGS的XRD谱图;(r) BGS和NBGS的XPS谱;(s) BGS和NBGS的拉曼光谱。
III NBGS的光热特性和抗肿瘤性能将NBGS用于体内抗肿瘤实验获得了较好的效果。支架植入后24小时在肿瘤部位进行NIR-II (1064 nm激光)光触发热消融。近红外照射3 min内,异种移植物表面温度升高至~56℃,明显高于对照组(~40℃)。次日,对随机采集的各组肿瘤标本进行H&E、TUNEL和Ki-67染色,观察骨肉瘤消融效果。TUNEL和H&E染色显示BGS组、BGS+NIR组、NBGS组凋亡肿瘤细胞较少,而NBGS+NIR组可见明显的核解离,肿瘤细胞大量死亡。Ki-67染色也支持TUNEL和H&E染色结果。这些结果表明,NBGS可以有效杀死肿瘤细胞。为了评价NBGS的急性毒性作用,在激光照射后24 h取小鼠主要器官进行H&E染色。治疗组和对照组均未出现明显的炎症浸润或其他病理异常,说明NBGS用于光热骨肿瘤消融具有良好的生物安全性。

图3. BGS/NBGS的光热特性及抗肿瘤性能。(a) PBS中1.0NBGS和BGS的温度变化曲线;(b) 不同处理后Saos-2细胞的相对活性;(c) 不同处理组Calcein-AM/PI染色;(d) 肿瘤组织的H&E、TUNEL和Ki-67染色图像;(e) 植入1.0 NBGS和BGS的小鼠模型在NIR-II激光照射后的温度曲线;(f) 不同治疗方案荷瘤小鼠的肿瘤体积;(g) 荷瘤小鼠体重;(h) 不同治疗组小鼠的生存曲线。
IV NBGS在体内和体外均可刺激血管新生
血管在骨修复的整个过程中起着至关重要的作用。血管新生与骨形成密切相关。当骨缺损发生时,成骨前体细胞通过新生血被管募集到损伤处参与成骨。该工作在体外及体内分析了BGS和NBGS促进血管形成方面的差异(如图4所示)。划痕实验和迁移实验结果表明,NBGS显著提高了HUEVCs的迁移能力。成管实验可见NBGS组分支数更多。为了阐明NBGS促进血管形成的机制,我们采用QPCR方法检测了成管相关基因的表达。与BGS组相比,NBGS可以持续促进VEGF-B和FGF2的表达,表明NBGS具有更好的促进血管生成的功能。体内实验中,将NBGS植入大鼠颅骨缺损处3周后,通过Microfil灌注观察支架周围的血管新生情况。实验可见围绕NBGS有更密集的血管网络。体内实验与体外结果一致。结果证明:从NBGS中释放的Nb可刺激血管化,是促进成骨耦合的理想元素。
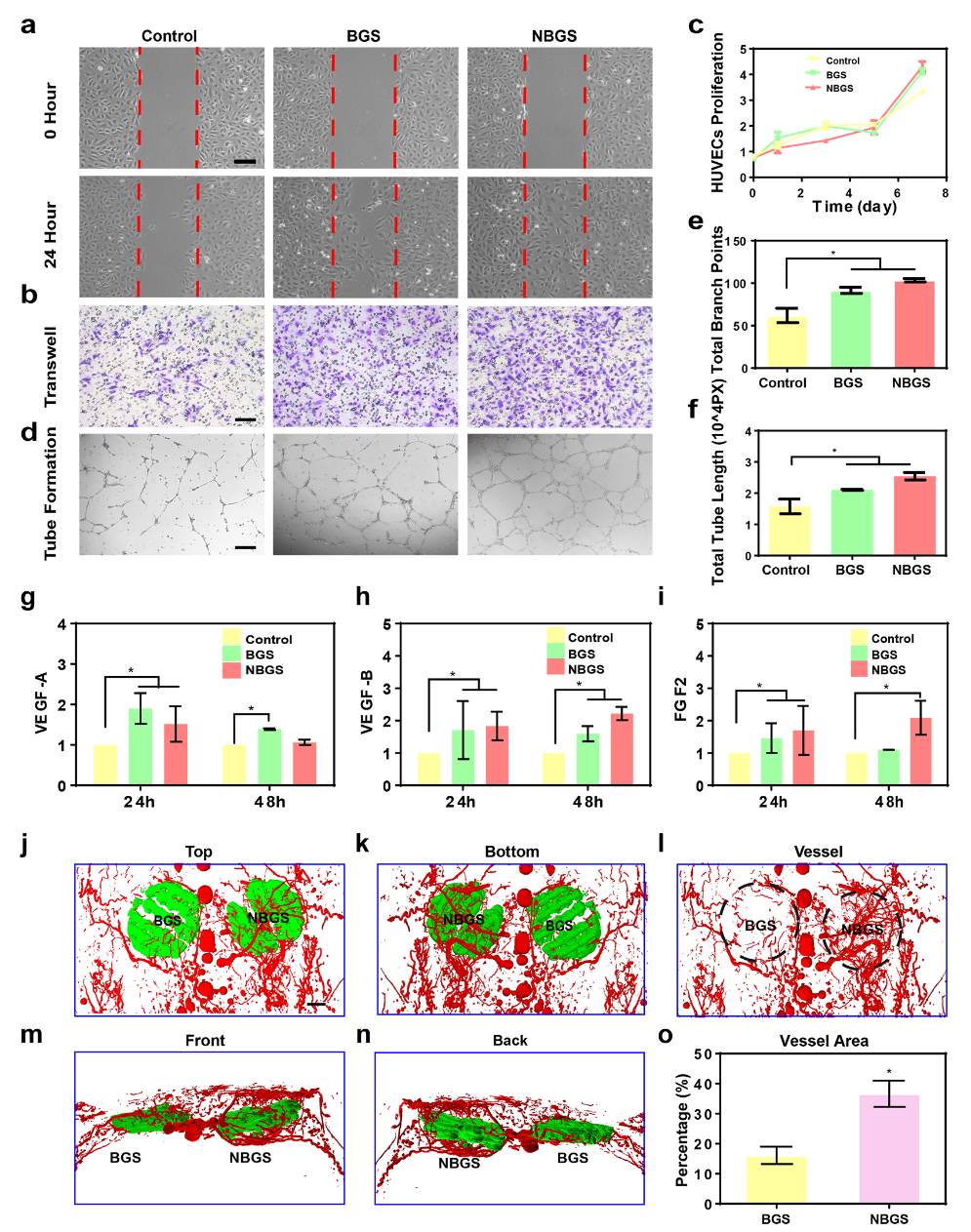
图4. BGS和NBGS在体内外刺激血管新生。(a) 划痕实验;(b) 迁移实验;(c) 增殖实验;(d-f) 成管效果分析;(j-n) 体内植入支架的三维重建图像;(o) 新生血管定量分析。
V NBGS在体外及体内成骨疗效评价
羟基磷灰石在间充质干细胞(MSC)增殖和成骨分化中发挥重要作用。Ca/P比值越接近羟基磷灰石组成,矿化能力越强。NBGS的Ca/P比值有利于MSC成骨分化和新生骨矿化,在体内具有更好的促进骨再生性能。与NBGS共培养的hBMSCs增殖更好。此外,细胞中成骨相关基因COL1、OCN和OPN的表达显著上调。茜素红染色结果与QPCR结果一致。因此,NBGS具有良好的生物活性、生物相容性和诱导成骨性能,可作为驱动骨再生的良好生物材料。SD大鼠骨缺损模型是目前研究骨缺损再生最常用的模型之一。通过构建SD大鼠颅骨骨缺损模型,植入NBGS和BGS后利用micro-CT评估NBGS促进骨再生的效果。结果表明NBGS促进骨新生能力明显高于BGS组。

图5. BGS/NBGS对成骨的影响。(a) 与BGS/NBGS共培养的hBMSCs的共聚焦图像;(b) 对照组、BGS组和NBGS组hBMSCs成骨基因(COL1、RUNX2、OCN、OPN)表达;(c) 茜素红染色;(d-l) micro-CT评估各组骨再生情况。
通过荧光三色实验对大鼠颅骨修复进一步评估(如图6所示)。与BGS组相比,NBGS支架表现出更好的诱导骨再生性能。通过H&E染色和Masson染色结果发现植入NBGS的骨缺损处有大量矿化骨组织,且未见明显残留支架。此外,Goldner染色显示,BGS组的缺损区在残余材料周围有新的类骨质(红色组织)混合物,而NBGS周围骨组织已经大量矿化成熟(绿色组织)。这一结果表明该支架具有良好的骨再生和降解能力。
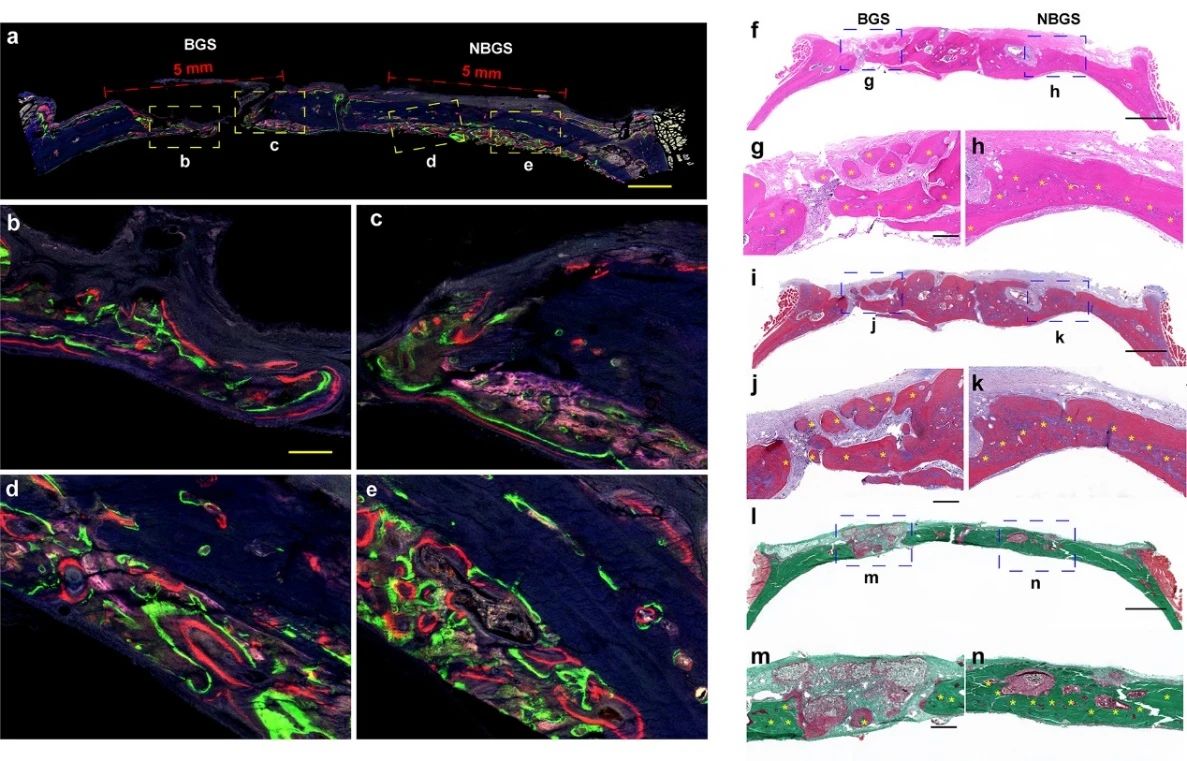
图6. 新生骨荧光成像和组织学染色。(a-e) 第2、4、6周皮下注射盐酸四环素(蓝色荧光)、钙黄绿素AM(绿色荧光)和茜素红(红色荧光),不同颜色的荧光代表不同时间的新生骨组织;(f-k) H&E染色、Masson染色及Goldner染色。
动物实验发现新骨沿支架孔隙长入(如图7所示)。这些结果表明在体内材料引导下骨再生良好,具有良好的骨传导性。图7g-i展示了不同时期新骨组织形成的过程。第8周时大量成纤维细胞分布在支架间隙。16周时支架生物降解伴随红色类骨质逐渐填充,展现了NBGS组的骨形成和支架降解过程的协同进行。前述研究证实了Nb₂C可以明显促进血管形成,通过丰富的血运可聚集更多的免疫细胞在缺陷部位周围,加速NBGS的降解。此外,大量的营养物质、氧气和骨髓间充质干细胞通过新生血管运往骨缺损部位,促进骨再生。NBGS的降解为骨重建提供了足够的空间。支架降解过程中释放的钙和磷酸盐可以促进新骨组织的矿化。与之相比,对照组因为新生血管稀少,原料供应不足,显著减缓了BGS支架的降解速度。
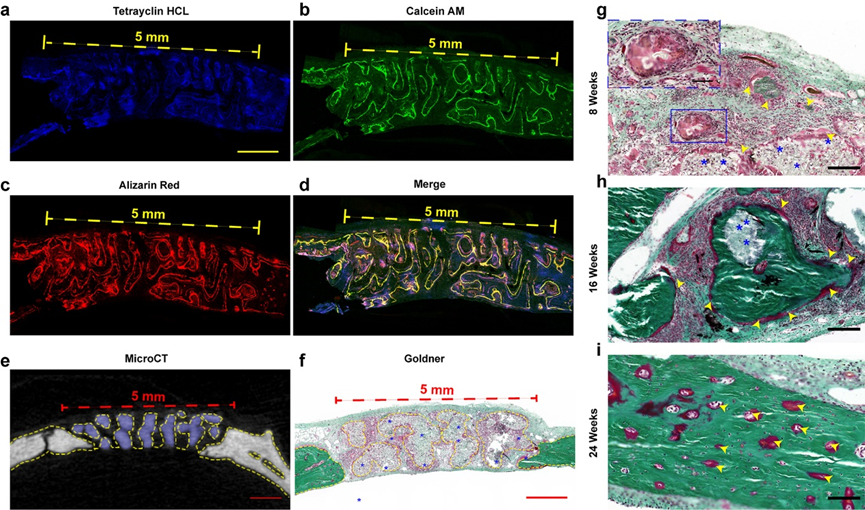
图7. 材料引导的体内骨组织再生。(a-d) 缺损区新生骨共聚焦成像;(e) microCT横切面成像;(f) 第8周NBGS组的Goldner染色;(g-i) 第8、16、24周NBGS组Goldner染色。
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
| 温馨提示:苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。网站部分文献案例图片源自互联网,图片仅供参考,请以实物为主,如有侵权请联系我们立即删除。 |
下一篇: 纳米医学产品1


