原位聚合策略让MOF 成为抗癌“穿山甲”
文章简介:
MOFs具有结构可控性、孔隙率可调性和易功能化修饰等优势,使其成为纳米药物的良好载体,但其生理稳定性较差,严重限制了在生物医学方面的应用。锌基MOFs在水中稳定性很差,尤其是在酸性水缓冲液中。镐基MOFs对含磷酸盐的缓冲液非常敏感,如磷酸盐缓冲盐水(PBS)和RPMI-1640培养基,两者都有较高的磷酸盐离子浓度,这一敏感性是由于Zr离子和客体磷酸盐离子之间有较强的结合亲和力。而无金属的COFs稳定性强,但生物相容性很差,不适宜用于生化研究。
为了促进MOFs的生物应用,MOFs纳米颗粒的外表面功能化通过在不饱和金属位点上的配位结合、与预功能化连接物的共价结合以及配体交换已经实现。尽管外表面功能化已取得成功,但迄今为止仅有少数易操作和可推广的刺激响应性细胞内药物释放系统。虽然磷酸盐离子可以引发许多Zr基MOFs的分解,但以均匀多孔的MOFs纳米颗粒为载体的磷酸盐响应药物递送系统尚未见报道,因为生理上的磷酸盐离子对MOFs的分解是不可控制的,尤其是在体内环境中。因此,Zhantong Wang等人设计了一种生理稳定性高、磷酸盐刺激响应功能强的ZrMOF使得MOFs在生物医学应用上更进一步。
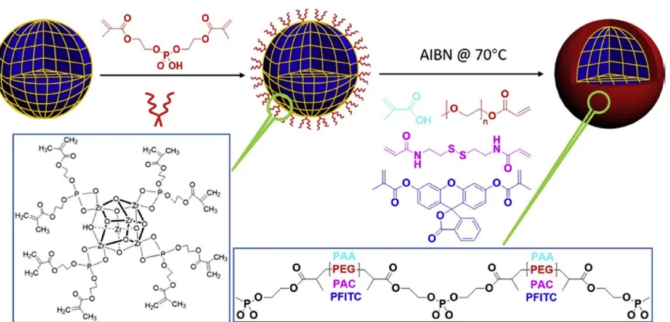
新型MOFs纳米颗粒原位聚合策略,即用功能化的聚合物包裹纳米颗粒,不仅为包裹的纳米颗粒提供内在稳定性,而且为纳米颗粒提供一种刺激响应性分解机制。作者为了将不同单体的功能聚合物包裹在MOF纳米颗粒表面,首先在MOFs表面用BMAP固定,再引入自由基引发剂AIBN,在BMAP上引发聚合反应后形成表面涂层,从而制备不同聚合物保护的MOFs。
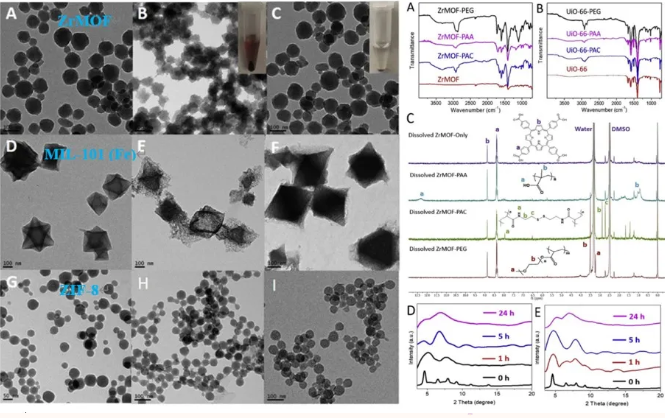
作者利用FTIR、NMR 和XRD图谱表征了不同聚合物成功包裹的MOFs纳米颗粒,并采用TEM图探究了不同MOF纳米颗粒在不同缓冲液中的稳定性,可以看出包裹聚合物后稳定性明显提高。
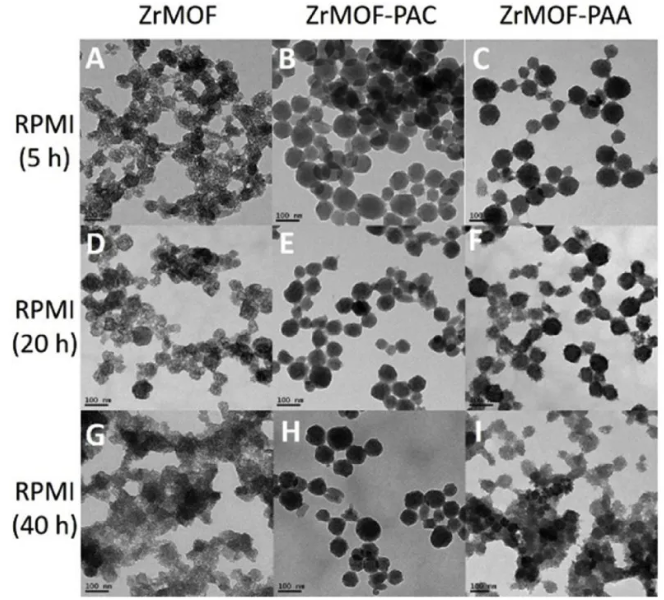
 ZrMOF在细胞培养基中的稳定性非常重要,在进行细胞活力研究时必须加以考虑,因此进一步测试了ZrMOF-only、ZrMOF-PAA和ZrMOF-PAC在常用细胞培养基RPMI-1640中的稳定性,而ZrMOF-PAC是三种包裹型ZrMOF中最稳定的。
ZrMOF在细胞培养基中的稳定性非常重要,在进行细胞活力研究时必须加以考虑,因此进一步测试了ZrMOF-only、ZrMOF-PAA和ZrMOF-PAC在常用细胞培养基RPMI-1640中的稳定性,而ZrMOF-PAC是三种包裹型ZrMOF中最稳定的。
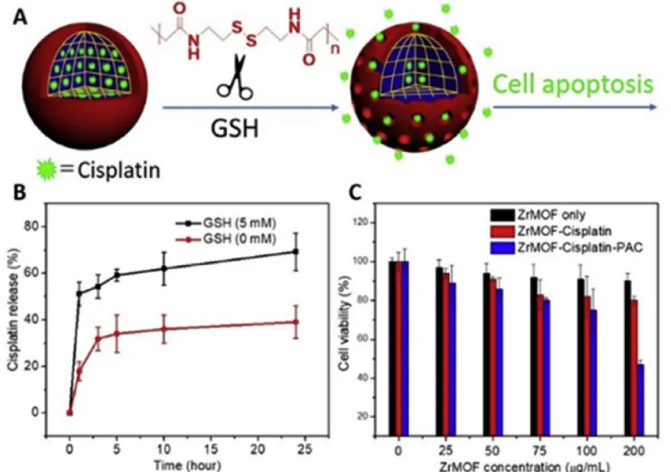
MOFs纳米颗粒表面聚合物不仅增加了其在缓冲液和介质中的稳定性,而且还提供了刺激反应药物传递等功能。作者使用负载化疗药物顺铂的ZrMOF-PAC进行细胞内药物递送实验,首先证明了ZrMOF-PAC的GSH-刺激响应性,这是由于GSH是启动PAC分解的触发器。在有GSH的情况下,根据ICP分析可以看到从ZrMOF-PAC中释放了50%的顺铂,20%的顺铂由于磷酸离子蚀刻和ZrMOF的分解而逐渐释放;而没有GSH的情况下,顺铂随时间逐渐释放,与GSH触发的ZrMOF-PAC相比近30%的顺铂被困在ZrMOF-PAC纳米颗粒内。其次,用MTT检测ZrMOF的抗癌活性,研究发现没有PAC包裹时,buffer清洗后负载的顺铂严重渗漏,癌症治疗效果相对较差;而聚合物包裹的ZrMOF- PAC可防止顺铂从纳米ZrMOF中泄露,保证药物的有效传递。细胞摄取后,癌细胞内的高水平GSH分解了ZrMOF表面的交联PAC聚合物,使得顺铂从MOF顺利释放。同时细胞内的磷酸盐离子蚀刻ZrMOF,加速药物释放,从而显示出更好的癌细胞治疗效果。
 总结语:作者设计了一种新型MOFs原位聚合策略,使不同纳米尺寸的MOFs (ZrMOF、MIL-101、ZIF-8和Uio-66)在体内外生理条件下的稳定性显著增强,特别是在磷酸盐溶液中。原位聚合使前药既能增加纳米MOFs的稳定性,又能在细胞内响应释放药物,提供了一个稳定、高效和安全的药物传递平台。磷酸盐等缓冲液介质对MOFs的影响,为我们材料合成和应用中出现问题的解决提供了新的思路。
总结语:作者设计了一种新型MOFs原位聚合策略,使不同纳米尺寸的MOFs (ZrMOF、MIL-101、ZIF-8和Uio-66)在体内外生理条件下的稳定性显著增强,特别是在磷酸盐溶液中。原位聚合使前药既能增加纳米MOFs的稳定性,又能在细胞内响应释放药物,提供了一个稳定、高效和安全的药物传递平台。磷酸盐等缓冲液介质对MOFs的影响,为我们材料合成和应用中出现问题的解决提供了新的思路。
备注:推文中所有图表摘自原文,本文仅对文献点评学习(水平有限,若有错误,敬请原谅)。
信息来源:高乐 ZhanGroup
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
MOFs具有结构可控性、孔隙率可调性和易功能化修饰等优势,使其成为纳米药物的良好载体,但其生理稳定性较差,严重限制了在生物医学方面的应用。锌基MOFs在水中稳定性很差,尤其是在酸性水缓冲液中。镐基MOFs对含磷酸盐的缓冲液非常敏感,如磷酸盐缓冲盐水(PBS)和RPMI-1640培养基,两者都有较高的磷酸盐离子浓度,这一敏感性是由于Zr离子和客体磷酸盐离子之间有较强的结合亲和力。而无金属的COFs稳定性强,但生物相容性很差,不适宜用于生化研究。
为了促进MOFs的生物应用,MOFs纳米颗粒的外表面功能化通过在不饱和金属位点上的配位结合、与预功能化连接物的共价结合以及配体交换已经实现。尽管外表面功能化已取得成功,但迄今为止仅有少数易操作和可推广的刺激响应性细胞内药物释放系统。虽然磷酸盐离子可以引发许多Zr基MOFs的分解,但以均匀多孔的MOFs纳米颗粒为载体的磷酸盐响应药物递送系统尚未见报道,因为生理上的磷酸盐离子对MOFs的分解是不可控制的,尤其是在体内环境中。因此,Zhantong Wang等人设计了一种生理稳定性高、磷酸盐刺激响应功能强的ZrMOF使得MOFs在生物医学应用上更进一步。
新型MOFs纳米颗粒原位聚合策略,即用功能化的聚合物包裹纳米颗粒,不仅为包裹的纳米颗粒提供内在稳定性,而且为纳米颗粒提供一种刺激响应性分解机制。作者为了将不同单体的功能聚合物包裹在MOF纳米颗粒表面,首先在MOFs表面用BMAP固定,再引入自由基引发剂AIBN,在BMAP上引发聚合反应后形成表面涂层,从而制备不同聚合物保护的MOFs。

作者利用FTIR、NMR 和XRD图谱表征了不同聚合物成功包裹的MOFs纳米颗粒,并采用TEM图探究了不同MOF纳米颗粒在不同缓冲液中的稳定性,可以看出包裹聚合物后稳定性明显提高。


MOFs纳米颗粒表面聚合物不仅增加了其在缓冲液和介质中的稳定性,而且还提供了刺激反应药物传递等功能。作者使用负载化疗药物顺铂的ZrMOF-PAC进行细胞内药物递送实验,首先证明了ZrMOF-PAC的GSH-刺激响应性,这是由于GSH是启动PAC分解的触发器。在有GSH的情况下,根据ICP分析可以看到从ZrMOF-PAC中释放了50%的顺铂,20%的顺铂由于磷酸离子蚀刻和ZrMOF的分解而逐渐释放;而没有GSH的情况下,顺铂随时间逐渐释放,与GSH触发的ZrMOF-PAC相比近30%的顺铂被困在ZrMOF-PAC纳米颗粒内。其次,用MTT检测ZrMOF的抗癌活性,研究发现没有PAC包裹时,buffer清洗后负载的顺铂严重渗漏,癌症治疗效果相对较差;而聚合物包裹的ZrMOF- PAC可防止顺铂从纳米ZrMOF中泄露,保证药物的有效传递。细胞摄取后,癌细胞内的高水平GSH分解了ZrMOF表面的交联PAC聚合物,使得顺铂从MOF顺利释放。同时细胞内的磷酸盐离子蚀刻ZrMOF,加速药物释放,从而显示出更好的癌细胞治疗效果。

备注:推文中所有图表摘自原文,本文仅对文献点评学习(水平有限,若有错误,敬请原谅)。
信息来源:高乐 ZhanGroup
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
| 温馨提示:苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。网站部分文献案例图片源自互联网,图片仅供参考,请以实物为主,如有侵权请联系我们立即删除。 |
下一篇: 纳米医学产品1


